微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(Ksp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是(?)
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离平衡常数Ka变小
C.Ksp(AgCl)>Ksp(AgI) ,由此可以判断AgCl(s) + I-(aq)=AgI(s)+ Cl-(aq)能够发生
D.Ka(HCN)<Ka(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强
参考答案:C
本题解析:平衡常数的大小与温度有关,A不正确;电离是吸热的,加热促进电离,电离常数增大,B不正确;酸的电离常数越大,酸性越强,D不正确。
本题难度:一般
2、选择题 在水溶液中,重铬酸钾K2Cr2O7存在以下平衡: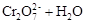

 ,下列说法正确的是
,下列说法正确的是
A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色
B.该反应不是氧化还原反应
C.向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大
D.该反应的平衡常数表达式是
参考答案:BC
本题解析:A、向该溶液中加入过量浓NaOH溶液,平衡向右移动,重铬酸根的浓度减小,铬酸根浓度增大,溶液呈黄色,错误;B、该反应没有元素化合价变化,不是氧化还原反应,正确;? C、向该溶液中滴加适量的浓硫酸,平衡向逆反应方向移动,再次达到平衡后,减弱氢离子浓度的增大而不能抵消,氢离子浓度比原溶液大,正确;D、该反应为水溶液中进行的反应,溶剂水不写入平衡常数表达式,错误。
本题难度:一般
3、填空题 请回答下列问题:
(1)分别用浓、稀硝酸溶解等量的两份铜粉,消耗硝酸的物质的量较少的是____?硝酸(填“浓”或“稀”),相应的离子方程式是?。
(2) 800℃时,在2 L的恒容密闭容器中充入2 mol NO和1mol O2发生反应,2NO(g)+O2(g) 2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
2NO2(g),经5min达到平衡,测得c(NO)=0.5mol/L,并放热Q kJ。
①5 min内 v(O2)=?。
②该条件下,2NO(g)+O2(g) 2NO2(g)的△H=?。
2NO2(g)的△H=?。
③若向平衡混合物中再充入NO、NO21mol,此时v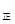 ?v
?v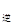 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
④若向平衡混合物中仅充入1mol NO2,平衡向____?(填“正向”、“逆向”或“不”)移动。达新平衡时,NO2的体积分数____?(填“增大”、“减小”或“不变”)。
(3)染料工业排放的废水中含有大量有毒的NO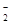 ,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____?。
,可以在强碱性条件下加入铝粉除去(反应过程中无气态产物生成。加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出)。请写出该反应的离子方程式____?。
参考答案:
(1)稀;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)①0.05 mol/(L·min)?②-2Q kJ/mol?③=?④逆向;增大
(3)2Al+NO2-+OH-+2H2O=2AlO2-+NH3·H2O
本题解析:
试题解析:(1)浓硝酸还原产物为NO2,稀硝酸还原产物为NO,转移电子数相同时,稀硝酸的用量少。
(2)①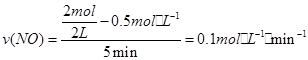 ,则v(O2)=0.05mol·L-1·min-1。
,则v(O2)=0.05mol·L-1·min-1。
②反应消耗NO:2mol-0.5mol/L×2L=1mol,放热QkJ,则消耗2molNO放热2QkJ。
③根据题中数据可知,平衡时NO、O2、NO2的物质的量浓度分别为0.5mol/L、0.25mol/L、0.5mol/L,则该温度下的平衡常数: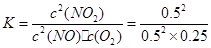 ?=4,加入NO、NO2各1mol,则NO、NO2浓度改变相同,因此Qc=K,平衡不移动,则正、逆反应速率相等。
?=4,加入NO、NO2各1mol,则NO、NO2浓度改变相同,因此Qc=K,平衡不移动,则正、逆反应速率相等。
④充入NO2则产物浓度增大,平衡逆向移动。因NO2浓度增大,因此平衡时其体积分数增大。
(3)根据加热反应后的溶液有能使湿润的红色石蕊试纸变蓝的气体逸出可知有氨水生成,则Al失电子,NO2-得电子,根据氧化还原反应电子得失守恒及电荷守恒,可写出化学方程式。
本题难度:一般
4、选择题 向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A,4 mol B和1 mol A,2 mol B。相同条件下,发生下列反应:A(g)+2B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是? ( )
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是? ( )

A.x可能等于3
B.向平衡后的乙容器中充入氦气可使A的转化率降低
C.将乙容器单独升温,c(A)可达到0.78 mol/L
D.若向甲容器中再充入2 mol A,4 mol B,平衡时甲容器中c(A)大于1.56 mol/L
参考答案:C
本题解析:分析可知甲装置相当于在乙装置基础上加压,但比乙中A浓度的2倍小,说明平衡正移,正向为气体体积减小的反应,所以可知x不能等于3,只能小于3,A错;恒温恒容,通惰性气体,平衡不移动,转化率不变,B错;升温,平衡逆向移动,c(A)增大,可达到0.78 mol/L,C正确;若向甲容器中再充入2 mol A,4 mol B,平衡正向移动,c(A)小于1.56 mol/L,D错。
本题难度:一般
5、选择题 下列关于冰熔化为水的过程判断正确的是
A.△H>0,△S<0
B.△H<0,△S>0
C.△H>0,△S>0
D.△H<0,△S<0
参考答案:C
本题解析:因为冰熔化需要吸热,所以△H>0;冰熔化成水,分子活动能力增强,混乱度增大,故△S>0。故C 正确。
考点:考察利用公式计算判断自发反应过程。
点评:正确理解焓判据和熵判据。
本题难度:一般