微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)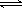
参考答案:
本题解析:
本题难度:一般
2、填空题 (9分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用。
①下图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:?。(△H的数值用含字母a、b的代数式表示)
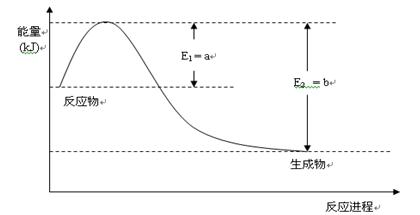
②氨气溶于水得到氨水。在25°C下,将m mol·L-1的氨水与n mol·L-1的盐酸等体积混合,反应后的溶液呈中性,则c(NH+4)?c(Cl-)(填“>”、“<”或“=”);用含m和n的代数式表示出混合液中氨水的电离平衡常数表达式?。
(2)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。
25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是?,向反应后的浊液中,继续加入适量0.1mol·L-1的NaI溶液,振荡、静置,看到的现象是?,产生该现象的原因是(用离子方程式表示)?。
(已知25°C时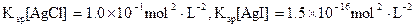 )
)
参考答案:
(1)①N2(g)+3H2(g)=2NH3(g);△H=-2(b-a)kJ·mol-1(2分)
②=(1分)? (2分)
(2分)
(2)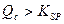 (1分)
(1分)
白色沉淀转化为黄色沉淀(1分)
AgCl+I-===AgI+Cl-(2分)
本题解析:略
本题难度:一般
3、填空题 一定条件下,在体积为3L的密闭容器中化学反应 CO(g)+2H2(g)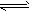 CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。

(1)该反应的平衡常数表示K=______________根据上图降低温度K将__________(填“增大”、
“减小”、“不变”)
(2)500℃时,从反应开始到达到平衡状态,以CO的浓度变化表示的化学反应速率是v(CO)=__________
(用nB、tB表示)
(3)判断可逆反应达到平衡状态的标志是_________________(填字母)
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.容器内气体的压强保持不变
d.CO、H2、CH3OH的浓度不再改变
(4)300℃时,讲容器的体积增大1倍,在其他条件不变的情况下,对平衡体系产生的影响是_________
(填字母)
a.c(H2)增大
b.正反应速率减慢,逆反应速率加快
c.CH3OH的物质的量减少
d.重新平衡时c(H2)/c(CH3OH)增大
参考答案:(1)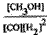 ;增大
;增大
(2)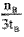 mol·L-1·min-1
mol·L-1·min-1
(3)cd
(4)cd
本题解析:
本题难度:一般
4、选择题 下列各表述与示意图一致的是
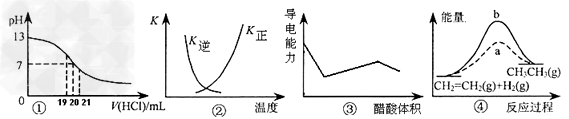
[? ]
A.图①表示25℃时,用0.1?mol/L盐酸滴定20?mL?0.1?mol/LKOH溶液,溶液的pH随加入酸体积的变化?
B.图②中曲线表示反应N2(g)+3H2(g) 2NH3(g)?ΔH?<?0?正、逆反应的平衡常数K随温度的变化
2NH3(g)?ΔH?<?0?正、逆反应的平衡常数K随温度的变化
C.图③表示用醋酸滴定NaOH和氨水混合溶液时,溶液的导电能力随醋酸体积变化的曲线
D.图④中a、b曲线分别表示反应CH2=CH2(g)+?H2(g)?→?CH3CH3(g);ΔH<?0使用和未使用催化剂时,反应过程中的能量变化
参考答案:C
本题解析:
本题难度:一般
5、选择题 一定温度下密封容器中发生可逆反应:mA(g) +nB(g)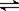 pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.8倍,则下列叙述正确的是
pC(g),达平衡后,若将气体体积压缩到原来的1/2。当再达平衡时C的浓度是原来的1.8倍,则下列叙述正确的是
A.C气体的体积分数增大
B.m+n>p
C.气体A的转化率升高
D.平衡向逆反应方向移动