微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:

2FeSO4?Fe2O3 + SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液、(II)x溶液、(III)NaOH溶液的三个装置。则下列对该方案的评价中正确的是(?)
A.(I)中会生成BaSO3、BaSO4两种沉淀
B.可将(I)中的BaCl2溶液改为Ba(NO3)2溶液
C.(III)的作用是检验生成的SO2气体
D.(II)所盛x应为品红溶液
参考答案:D
本题解析:
 试题分析:工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:
试题分析:工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:
2FeSO4?Fe2O3 + SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I)BaCl2溶液,其作用是出去气体二氧化硫和三氧化硫,不能将其换成硝酸钡,硝酸具有强氧化性,不能验证生成的气体物质。(II)x溶液 其作用是检验气体是不是除干净了、(III)NaOH溶液,其作用是尾气处理。所以(II)所盛x应为品红溶液,故选D。
点评:本题考查的知识均源自于课本,学生一定要熟悉基本的课本知识,多积累这方面的知识,此题便不难解决。
本题难度:一般
2、实验题 (10分)
(1)浓硫酸和木炭(C)加热时反应的化学方程式为:
?;
为了验证反应的全部生成物,用下图装置进行实验。

(2)上图A处是完成实验的必要装置,它是下列图中的(填编号)?;

(3) C装置中盛放的试剂为?,
其作用是?;
(4)能够证明存在CO2气体的实验现象是:
?。
参考答案:(1)C + 2H2SO4(浓)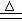 CO2↑ + 2SO2↑ + 2H2O;(2分)
CO2↑ + 2SO2↑ + 2H2O;(2分)
(2)③(2分)
(3)酸性KMnO4溶液(2分)?除去SO2;(2分)
(4)C中酸性KMnO4溶液不褪色,同时D中澄清石灰水变混浊。(2分)
本题解析:由反应C + 2H2SO4(浓) CO2↑ + 2SO2↑ + 2H2O知道,由于CO2和SO2的检验过程中都需要水溶液,故产物检验时必须先检验水,一般用无水硫酸铜;
CO2↑ + 2SO2↑ + 2H2O知道,由于CO2和SO2的检验过程中都需要水溶液,故产物检验时必须先检验水,一般用无水硫酸铜;
而CO2和SO2均为酸性氧化物,性质相近,而SO2具有还原性、漂白性,是独有性质,故可用品红溶液来检验它的存在,再用酸性KMnO4溶液进行吸收,随后用澄清石灰水检验CO2的存在。
本题难度:一般
3、选择题 向下列溶液中通入足量SO2的过程中,一定不会产生沉淀的是?(?)
A.Ba(OH)2
B.Ba( NO3)2
C.Na2S
D.BaCl2
参考答案:D
本题解析:略
本题难度:一般
4、填空题 如图每一方框中的字母代表一种反应物或生成物。产物J是含金属元素A的白色胶状沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白。
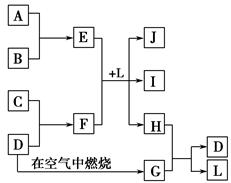
(1)框图中所列物质中属于非电解质的物质的化学式是?。
(2)用电子式表示出H的形成过程?。
(3)将E的水溶液蒸干并灼烧得到的固体物质的化学式为?。
(4)F的水溶液中各离子浓度由大到小的顺序为?。
(5)F的水溶液显碱性的原因:?(用离子方程式表示)。
(6)E与F在L中反应的离子方程式为?。
(7)H和G之间反应的化学方程式为?。
参考答案:(1)SO2
(2) 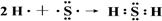
(3)Al2O3
(4)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
(5)S2-+H2O?HS-+OH-
(6)2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
(7)2H2S+SO2=3S↓+2H2O
本题解析:根据J是含金属元素A的白色胶状沉淀,可推断出A是Al,J是Al(OH)3;根据D是淡黄色固体单质,可推断出D为S。从图示转化关系知,E是含铝的化合物,F是含硫的化合物,结合I为NaCl溶液,可以推断出E是AlCl3、F是Na2S、L是H2O,则B 为Cl2,C为Na。G是SO2,结合SO2的性质及G与H的反应,可推断出H是H2S。(1)框图中只有SO2为非电解质。(3)AlCl3蒸干时水解得到Al(OH)3,灼烧最终得到Al2O3。(4)Na2S溶液中由于S2-水解溶液显碱性,离子浓度大小为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。(5)S2-水解的离子方程式为S2-+H2O HS-+OH-。(6)Al3+与S2-发生相互促进的水解反应:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。(7)该反应为硫元素的归中反应:2H2S+SO2=3S↓+2H2O。
HS-+OH-。(6)Al3+与S2-发生相互促进的水解反应:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。(7)该反应为硫元素的归中反应:2H2S+SO2=3S↓+2H2O。
本题难度:一般
5、选择题 某同学利用下列装置进行浓硫酸和铜反应并验证二氧化硫的性质。按如图实验装置连接仪器和放置药品。加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出。实验结束后会看到两个试管的液体底部均有少量的白色固体。下列对该实验的现象分析或推断正确的是

A.湿润的蓝色石蕊试纸先变红后褪色
B.左边试管出现的白色固体是由于浓硫酸的脱水性所致
C.从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应
D.本实验体现了二氧化硫的酸性、漂白性和弱氧化性
参考答案:C
本题解析:A、SO2不能漂泊石蕊,所以蓝色石蕊试纸变红,不会褪色,错误;B、Cu与浓硫酸反应生成CuSO4,左边试管出现的白色固体为无水CuSO4,错误;C、加热浓硫酸约1分钟后撤去酒精灯,反应继续进行,说明铜与浓硫酸的反应是放热反应,正确;D、湿润的蓝色石蕊试纸变红,体现了SO2溶于水后显酸性,吸有品红溶液的滤纸褪色,体现了SO2的漂白性,但本实验无法证明二氧化硫的弱氧化性,错误。2的性质。
本题难度:一般