微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 分析下图装置,回答问题:
(1)装置A的烧瓶中发生的反应的化学方程式为?,?
(2)装置C的直玻管中发生的反应的化学方程式为?,
(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是?,
(4)装置E中NaOH的作用是?,反应的离子方程式为?;
(5)B装置的作用很多,除了可以混匀气体外,
还可以:____________________;? __________________________________。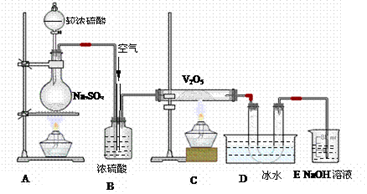
参考答案:(1)Na2SO3+H2SO4=Na2SO4+H2O+SO2,(2)2SO2+O2==2SO3,
(3)吸收尾气,SO2+2OH-=SO32-+2H2O;
(4)与圆底烧杯相接导管的气泡速度与直玻管中气泡速度之比为2:1(SO2与O2的气泡之比为2:1);干燥气体
本题解析:该实验装置图为在A产生了二氧化硫,气体在B中被干燥,然后二氧化硫和氧气在五氧化二钒催化加热下生成了三氧化硫,三氧化硫的凝固点很低,在D中被凝结,E为除去还没有反应的二氧化硫,所以(1)装置A的烧瓶中发生的反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2,(2)装置C的直玻管中发生的反应的化学方程式为:2SO2+O2==2SO3,(3)在装置D的U形管中有无色晶体生成,此晶体的化学式是SO3;(4)装置E中NaOH的作用是吸收尾气,其反应的离子方程式为SO2+2OH-=SO32-+2H2O;(5)B装置的作用很多,可以用来混合气体,也可以与圆底烧杯相接导管的气泡速度与直玻管中气泡速度之比为2:1(SO2与O2的气泡之比为2:1);干燥气体。
点评:本题考查了三氧化硫的制备实验,解答该题的关键是要分析该题的各个小装置作用,本题有利于培养学生分析实验的能力,该题难度适中。
本题难度:一般
2、选择题 下列气体通入BaCl2溶液中,有白色沉淀生成的是
A.CO2
B.SO2
C.SO3
D.NH3
参考答案:C
本题解析:分析:二氧化碳、二氧化硫、氨气与BaCl2溶液不发生化学反应,三氧化硫与BaCl2溶液反应生成硫酸钡沉淀,以此来解答.
解答:A.二氧化碳气体通入BaCl2溶液中不反应,无沉淀,故A不选;
B.二氧化硫气体通入BaCl2溶液中不反应,无沉淀,故B不选;
C.三氧化硫气体通入BaCl2溶液反应生成硫酸钡沉淀,故C选;
D.氨气气体通入BaCl2溶液中不反应,无沉淀,故D不选;
故选C.
点评:本题考查物质的性质,涉及常见的几种气体与盐溶液的反应,注意酸性的强弱及硫酸钡不溶于水、不溶于酸,题目难度不大.
本题难度:困难
3、选择题 下列物质中,和氢硫酸反应,但不能产生沉淀的是?(?)。
A.Pb(NO3)2溶液
B.Na2S洛液
C.CuSO4溶液
D.稀H2SO4
参考答案:B
本题解析:A中生成PbS沉淀,B中生成NaHS,C中生成CuS沉淀,D中不反应,答案选B。2S的性质
点评:该题是识记性知识的考查,重点考查学生对H2S性质的熟悉了解程度,旨在考查学生灵活运用基础知识解决实际问题的能力,难度不大,熟练记住并能灵活运用即可。
本题难度:一般
4、填空题 直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表:
n(SO32-)∶n(HSO3-)
| 91∶9
| 1∶1
| 9∶91
|
pH
| 8.2
| 7.2
| 6.2
|
?
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012·福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是________(填序号)。
HSO3-+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
参考答案:(1)SO2+H2O?H2SO3、2H2SO3+O2 2H2SO4
2H2SO4
(2)2OH-+SO2=H2O+SO32-
(3)①酸 HSO3-存在:HSO3- H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O H2SO3+OH-,HSO的电离程度大于水解程度
H2SO3+OH-,HSO的电离程度大于水解程度
②ab
(4)C
本题解析:(1)二氧化硫形成硫酸型酸雨的过程为二氧化硫与水反应生成亚硫酸,亚硫酸再被氧化成硫酸。
(2)氢氧化钠溶液吸收二氧化硫生成亚硫酸钠和水,而亚硫酸钠溶液可以继续吸收二氧化硫生成亚硫酸氢钠。
(3)①由表格数据知,随n(HSO3-)的增大,溶液酸性增强,即HSO3-的电离程度大于水解程度,亚硫酸氢钠溶液呈酸性。②由表格数据知,当溶液中亚硫酸氢钠的浓度略大于亚硫酸钠的浓度时,溶液呈中性,故离子浓度关系有c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),b正确。由电荷守恒式c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),中性溶液中c(H+)=c(OH-)知,a正确,c错误。
(4)H2SO4溶液显酸性、氯水具有漂白作用,A、B均不能证明平衡移动了;加入BaCl2溶液后,平衡发生移动。
本题难度:一般
5、选择题 下列反应中硫酸既表现氧化性,又表现酸性的是
A.氧化铝和硫酸
B.氧化铜和硫酸
C.硫化氢和硫酸
D.铜和浓硫酸
参考答案:D
本题解析:略
本题难度:简单