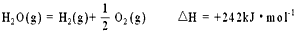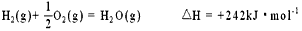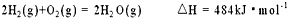微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=-169kJ·mol-1,
C(s)+1/2O2(g)=CO(g);△H=-110.5kJ·mol-1,
Cu(s)+1/2O2(g)=CuO(s);△H=-157kJ·mol-1
用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式是:
(2)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) 2SO3(g),写出该反应的化学平衡常数表达式:
2SO3(g),写出该反应的化学平衡常数表达式:
(3)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为: 。
(4)铁在潮湿的空气中发生吸氧腐蚀的电池反应方程式为 。
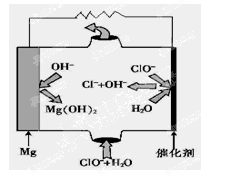
(5)“镁—次氯酸盐”燃料电池,其装置示意图如图,该电池反应的总反应方程式为_______________。
(6)工业上电解熔融氯化钠的方程式为 。
参考答案:(1)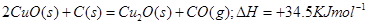
(2)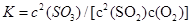
(3)
(4)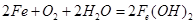
(5)Mg+ClO-+H2O=Mg(OH)2↓+Cl-
(6)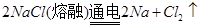
本题解析:(1)由盖斯定律,可知
(2)根椐平衡常数的定义知: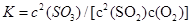
(3)甲烷被氧化,失去电子;电极反应式的书写要求,质量守恒,电荷守恒。
(4)铁在空气中接触氧气和水,被氧化为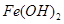 ;
;
(5)先写出电极反应方程式:
负极:Mg-2e-=Mg2+
正极:ClO-+2e-+H2O=Cl-+2OH-
因此总反应为:Mg+ClO-+H2O=Mg(OH)2↓+Cl-
(6)电解熔融的氯化钠:阴极:2Na++2e-=Na;阳极:2Cl
本题难度:一般
2、填空题 甲醇是一种重要的可再生能源,工业上可用CO和H2合成。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=—283 kJ·mol—1
CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l) △H=—725kJ·mol—1
若要求得CO(g)+2H2(g)=CH3OH(l)的△H,还需要知道反应(用化学方程式表示) 的焓变。
(2)在Cu2O/ZnO做催化剂的条件下,将CO(g)和H2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图。

根据题意回答下列问题:
①反应达到平衡时,平衡常数表达式K= ;
升高温度,K值 (填“增大”、“减小”
或“不变”)。
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的1/2,达到新的平衡后,下列有关该体系的说法正确的是 。
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加 d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是: (写出相关的化学方程式并辅以必要的文字说明)。
参考答案:(1)2H2(g)+O2(g)=2H2O(l)(只要写对反应式即给1分。没配平扣1分,没标明状态扣1分,若二者都存在只扣1分。)
(2)①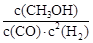 ; 减小。②0.2mol·L—1·s—1(没有单位或错扣1分)。③bc(各1分。填错一个倒扣1分,不出现负分。)。
; 减小。②0.2mol·L—1·s—1(没有单位或错扣1分)。③bc(各1分。填错一个倒扣1分,不出现负分。)。
④Cu2O+CO 2Cu+CO2,体系中有CO2可以抑制Cu2O被还原。(3分。化学方程式给1分,文字说明
2Cu+CO2,体系中有CO2可以抑制Cu2O被还原。(3分。化学方程式给1分,文字说明
本题解析:
本题难度:困难
3、填空题 (8分)甲醇是一种优质燃料,可制作燃料电池。

(1)工业上可用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1 ②CO2(g)+3H2(g)
CH3OH(g) ΔH1 ②CO2(g)+3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
已知:③2H2(g)+ O2(g) = 2H2O(g) ΔH3。则2CO(g)+O2(g)=2CO2(g) 的反应热
ΔH=______(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、 减小、不变)。负极的电极反应式为_______ ____。

(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ;阳极泥为:
参考答案:(1)2△H1-2△H2+△H3; (2)>;<;
(3)减小 CH3OH-6e-+8OH-=CO32-+6H2O(4)粗铜,精铜,Ag、Au
本题解析:(1)①×2-②×2+③,整理可得2CO(g)+O2(g)=2CO2(g) ΔH=2△H1-2△H2+△H3;(20由于升高温度,CH4的平衡转化率增大。根据平衡移动原理:升高温度,平衡向吸热反应方向移动,所以正反应方向是吸热反应,ΔH4>0;增大压强,平衡逆向移动,CH4的平衡转化率降低。根据图示可知P1<P2(3)某实验小组设计如图b所示的甲醇燃料电池装置,工作原理是2CH3OH+3O2+4KOH=2K2CO3+6H2O,可见工作一段时间后,溶液的pH减小。负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是粗铜,阴极材料 是精铜;在阳极上Cu及活动性比Cu强的金属Fe等失去电子,变为金属阳离子进入溶液,而活动性比Cu弱的金属Ag、Au等就沉淀在阳极底层,俗称阳极泥,所以阳极泥为Ag、Au。
考点:考查盖斯定律的应用、温度、压强对物质转化率的影响、燃料电池的各种原理及电镀的知识。
本题难度:困难
4、选择题 下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+1/2O2(g)===CO(g) ΔH2
②NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH3
NaOH(aq)+HNO3(aq)===NaNO3(aq)+H2O(l) ΔH4
③H2(g)+1/2O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.①
B.②④
C.③④
D.①②③