微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应(均为可逆反应):
①CO(g)+ 2H2(g) = CH3OH(g) △H1=—90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H2=—49.0 kJ·mol-1
水煤气变换反应③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=—41.1 kJ·mol-1
二甲醚合成反应④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1
(1)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
(2)一定温度下,在恒容密闭容器中进行反应①,下列描述能说明反应到达平衡状态的是 。
a.容器中气体平均相对分子质量保持不变
b.容器中气体密度保持不变
c.CH3OH(g)浓度保持不变
d.CH3OH(g)的消耗速率等于H2 (g)的消耗速率
(3)一定温度下,将8mol CH3OH(g)充入5L密闭容器中进行反应④,一段时间后到达平衡状态,反应过程中共放出49kJ热量,则CH3OH(g)的平衡转化率为 ,该温度下,平衡常数K= ;该温度下,向容器中再充入2mol CH3OH(g),对再次达到的平衡状态的判断正确的是 。
a.CH3OH(g)的平衡转化率减小
b.CH3OCH3 (g)的体积分数增大
c.H2O(g)浓度为0.5mol·L-1
d.容器中的压强变为原来的1.25倍
(4)二甲醚—氧气燃料电池具有启动快,效率高等优点,其能量密度高于甲醇燃料电池,若电解质为酸性,二甲醚—氧气燃料电池的负极反应为 ;消耗2.8L(标准状况)氧气时,理论上流经外电路的电子 mol
参考答案:(1)2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△=-204.7 kJ/mol,
(2)ac (3)50% 0.25 cd (4)CH3OCH3+3H2O-12e-=2CO2+12H+, 0.5
本题解析:由已知的方程式①×2+④得2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)△=-204.7 kJ/mol,
(2)由反应①可知ac说明反应达平衡状态。
(3)根据反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1当放热为49k J时消耗甲醇
4mol 4mol 2mol 2mol
结合平衡常数k=c(CH3OCH3)c(H2O)/
C2(CH3OH)得0.25,当再冲入2mol甲醇时化学平衡不会移动且平衡常数不变,确定C对,压强为原来的1.25倍。
(4)电解质为酸性电池的负极反应式为CH3OCH3+3H2O-12e-=2CO2+12H+,正极反应式为
4H++O2+4e-=4H2O,消耗2.8L氧气时转移电子为0.5mol。
考点:盖斯定律、化学平衡状态的标志、化学平衡常数、原电池原理、电子反应式的书写。
本题难度:困难
2、计算题 (10分)(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
(2)已知:C3H8(g ) ==== CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJ·mol-1
CH3CH=CH2(g) ==== CH4(g)+HC≡CH(g) △H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g)====CH3CH=CH2 (g)+H2(g)的△H= kJ·mol-1。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如右表:已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
物 质
| 燃烧热(kJ·mol-1)
|
H2(g)
| -285.8
|
CO(g)
| -283.0
|
CH4(g)
| -890.3
|
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式 。
参考答案:(10分) (1) 1、6NA 173、4 (2) +124、2
(3)CH4(g) + H2O(g) ="=" CO(g) + 3H2(g) ?H= --1420、7 kJ/mol
(4) N2 + 6e + 8H+ ="=" 2NH4+
本题解析:(1)根据盖斯定律可知,①+②即得到CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。标准状况下4.48 L CH4的物质的量为0.2 mol,失去0.2mol×8=1.6mol电子,放出的热量为0.2 mol×867 kJ·mol-1=173.4 kJ。
(2)同样根据盖斯定律可知,①-②即得到C3H8(g)====CH3CH=CH2 (g)+H2(g),所以该反应的△H=+156.6kJ·mol-1-32.4kJ·mol-1=+124.2kJ/mol。
(3)根据物质的燃烧热可知,①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1、②CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1、③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1、④ H2O(g)=H2O(l) △H=-44.0 kJ/mol。所以根据盖斯定律可知,③+④-①×3-②即得到CH4(g) + H2O(g) ="=" CO(g) + 3H2(g) ?H= --1420、7 kJ/mol。
(4)原电池中正极得到电子,所以氮气在正极得到电子。又因为溶液显酸性,所以正极电极反应式是N2 + 6e + 8H+ ="=" 2NH4+。
考点:考查反应热的计算、热化学方程式的书写以及电极反应式的书写等
点评:书写热化学方程式以及反应热的计算中,盖斯定律有着广泛的应用,需要熟练掌握并结合有关数学知识灵活运用。
本题难度:困难
3、选择题 25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是
[? ]
A.C(s)+1/2O2(g)==CO(g) △H=-393.5kJ/mol
B.2H2(g)+O2(g)==2H2O(g) △H=+571.6kJ/mol
C.CH4(g)+2O2(g)==CO2(g)+2H2O(g) △H=-890.3kJ/mol
D.1/2C6H12O6(s)+3O2(g)==3CO2(g)+3H2O(l) △H=-1400kJ/mol
参考答案:D
本题解析:
本题难度:一般
4、填空题 (1)已知:2NO2(g) N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。

①a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
②前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1。反应在第一个平衡点的平衡常数K(1)= (可用分数表示)。反应在第二个平衡点的平衡常数K(2)与第一个平衡点的平衡常数K(1)的关系:K(2) K(1)(填“>”、“=”或“<”)。
③请在右图坐标中画出1 mol N2O4通入2L的密闭容器中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(2)右图中a、b、c、d分别代表氧族元素(ⅥA族):Te(碲)、Se(硒)、S、O氢化物的反应热的数据示意图。试回答下列问题:

①请你归纳:非金属元素氢化物的稳定性与形成氢化物的反应热△H的关系 。
②写出硒化氢发生分解反应的热化学反应方程式: 。
参考答案:(1)①b,d ② 0.04(1分) 10/9 =(1分)
③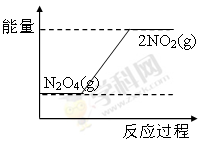 或
或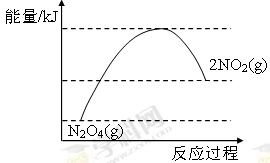
(2)①非金属元素氢化物越稳定,△H越小,反之亦然;②H2Se(g)=Se(s)+H2(g) △H=-81kJ/mol
本题解析:(1)①由图可知,10~25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故答案为:b、d。
②根据化学计量数和图像的变化趋势可知,X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线。由图可知,前10min内,NO2的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,所以υ(NO2)=0.4mol/L÷10min=0.04mol?L-1?min-1。根据图像可知,反应在第一个平衡点是NO2和N2O4的浓度分别是0.6mol/L和0.4mol/L,则该反应的平衡常数K(1)=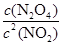 =
=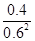 =
= 。在25min时NO2的浓度增大,N2O4浓度不变,这说明改变的条件一定不是温度,只能是增大生成物的浓度。平衡常数只与温度有关系,所以平衡常数不变,即K(2)=K(1)。
。在25min时NO2的浓度增大,N2O4浓度不变,这说明改变的条件一定不是温度,只能是增大生成物的浓度。平衡常数只与温度有关系,所以平衡常数不变,即K(2)=K(1)。
③NO2转化为N2O4的反应是放热反应,所以其能量变化示意图为 或
或 。
。
(2)①根据图像可知,Te(碲)、Se(硒)、S、O氢化物的反应热逐渐降低,而氢化物的稳定性逐渐升高,这说明非金属元素氢化物越稳定,△H越小,反之亦然;
②根据图像可知,硒化氢的反应热是+81kJ/mol,所以硒化氢发生分解反应是放热反应,则其热化学反应方程式H2Se(g)=Se(s)+H2(g) △H=-81kJ/mol。
考点:考查考查平衡状态的判断;反应速率与平衡常数的计算与判断;反应热的应用与计算
本题难度:困难
5、填空题 科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
I.四种制取Cu2O的方法
(a)用炭粉在高温条件下还原CuO制备Cu2O;
(b)用葡萄糖还原新制的Cu(OH)2制备Cu2O;
(c)电解法制备Cu2O。原理如图所示,则阳极电极反应可以表示为_________________;
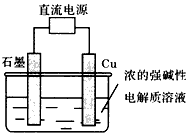
(d)最新实验研究加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。该制法的化学方程式为___________________
Ⅱ.用制得的Cu2O进行催化分解水的实验:
(1)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:
2H2O(g)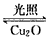 2H2(g)+O2 (g) △H=+484kJ/mol 不同时段产生O2的量见下表
2H2(g)+O2 (g) △H=+484kJ/mol 不同时段产生O2的量见下表

前20min的反应速率v(H2O)=____________;该温度下,反应的平衡常数的表达式K=___________;达平衡时,至少需要吸收的光能为__________kJ。
(2)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的体积V(H2)随时间t变化如图所示。下列叙述正确的是________(填字母代号)。
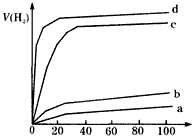
A.c、d方法制得的Cu2O催化效率相对较高
B.d方法制得的Cu2O做催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度
参考答案:Ⅰ.(c)2Cu+2OH--2e-=Cu2O+H2O;(d)4Cu(OH)2+N2H4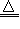 2Cu2O+N2+6H2O
2Cu2O+N2+6H2O
Ⅱ.(1)5×10-5mol/(L·min);C2(H2)·c(O2)/[c2(H2O)];0.97;(2)ACD
本题解析:
本题难度:一般