微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)写出298 K时,下列反应的热化学方程式:
(1)1mol HgO(s)分解为液态汞和氧气,吸热90.7 kJ。____________________________________
(2)在稀溶液中1 mol H2SO4与足量NaOH反应放热114.6 kJ,表示该中和热的热化学方程式为
(3)在101 kPa时,H2在1 mol O2中完全燃烧生成2 mol液态水,放出571.6 kJ的热量,H2的燃烧热为 ,表示H2燃烧热的热化学方程式为_
(4)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知N2 (g) + 2O2 (g) =2NO2 (g) △H ="+67.7" kJ/mol
N2H4 (g) +O2 (g) =N2 (g) + 2H2O (g) △H =" -534" kJ/mol
则N2H4 (g)和二氧化氮反应的热化学方程式为
参考答案:(1)HgO(s)="Hg(l)+" 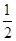 O2(g) △H ="+90.7" kJ/mol(2分)
O2(g) △H ="+90.7" kJ/mol(2分)
(2)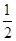 H2SO4(aq)+NaOH(aq)===
H2SO4(aq)+NaOH(aq)===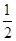 Na2SO4(aq)+H2O(l) △H =" -57.3" kJ/mol(2分)
Na2SO4(aq)+H2O(l) △H =" -57.3" kJ/mol(2分)
(3) 285.8kJ/mol (1分)
H2(g)+ 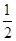 O2(g)===H2O(l);ΔH=-285.8kJ·mol-1(2分)
O2(g)===H2O(l);ΔH=-285.8kJ·mol-1(2分)
(4) 2N2H4 (g) +2 NO2 (g)="3" N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1(2分)
本题解析:(1)根据热化学方程式的书写原则,物质要注明状态,反应热与物质的物质的量有对应关系,物质的系数为物质的量,故写成HgO(s)="Hg(l)+" 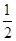 O2(g) △H ="+90.7" kJ/mol ;(2)根据中和热的定义,稀的强酸强碱反应生成1摩尔水时放出的热量为中和热,根据热化学方程式的书写原则写成
O2(g) △H ="+90.7" kJ/mol ;(2)根据中和热的定义,稀的强酸强碱反应生成1摩尔水时放出的热量为中和热,根据热化学方程式的书写原则写成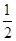 H2SO4(aq)+NaOH(aq)===
H2SO4(aq)+NaOH(aq)===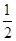 Na2SO4(aq)+H2O(l) △H =" -57.3" kJ/mol ;(3)氢气的燃烧热是指1摩尔氢气反应生成液态水时放出的热量,根据题意,是2摩尔氢气反应放热571.6 kJ ,所以1摩尔氢气放热285.8kJ ,氢气的燃烧热为285.8kJ/mol ,燃烧热的热化学方程式写成H2(g)+ 1/2 O2(g)===H2O(l);ΔH=-285.8kJ/mol ;(4)将所给的热化学方程式标为①和②,运用盖斯定律,②×2-①得出N2H4 (g)和二氧化氮反应的热化学方程式为2N2H4 (g) +2 NO2 (g)="3" N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1。
Na2SO4(aq)+H2O(l) △H =" -57.3" kJ/mol ;(3)氢气的燃烧热是指1摩尔氢气反应生成液态水时放出的热量,根据题意,是2摩尔氢气反应放热571.6 kJ ,所以1摩尔氢气放热285.8kJ ,氢气的燃烧热为285.8kJ/mol ,燃烧热的热化学方程式写成H2(g)+ 1/2 O2(g)===H2O(l);ΔH=-285.8kJ/mol ;(4)将所给的热化学方程式标为①和②,运用盖斯定律,②×2-①得出N2H4 (g)和二氧化氮反应的热化学方程式为2N2H4 (g) +2 NO2 (g)="3" N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1。
考点:中和热,燃烧热,热化学方程式的书写和含义,盖斯定律。
本题难度:一般
2、选择题 今有如下三个热化学方程式:下列关于它们的表述正确的是( ? )
H2(g)+ O2(g)=H2O(g);△H=akJ/mol
O2(g)=H2O(g);△H=akJ/mol
H2(g)+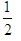 O2(g)=H2O(l);△H=bkJ/mol
O2(g)=H2O(l);△H=bkJ/mol
2H2(g)+O2(g)=2H2O(l);△H=ckJ/mol.
A.它们都是吸热反应
B.a、b和c均为正值
C.反应热的关系:a=b
D.反应热的关系:2b=c
参考答案:D
本题解析:
本题难度:简单
3、选择题 火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。已知:

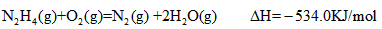
则N2H4和NO2反应的热化学方程式为
[? ]
A.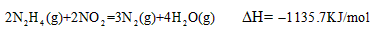
B.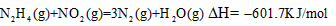
C.
D.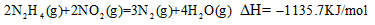
参考答案:D
本题解析:
本题难度:一般
4、选择题 2003年10月15日我国成功发射了第一艘载人航天飞船“神舟五号”(下图)。从此我国进入了航天大国和航天强国行列。发射“神五”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:
N2(g)+ 2O2(g)=2NO2(g) △H=+67. 7kJ/mol。
N2H4(g)+O2(g)=N2(g)+ 2H2O(g) △H= - 534kJ/mol.。
下列关于肼和NO2反应的热化学方程式中,正确的是

[? ]
A. 2N2H4 (g) +2NO2(g)=3N2(g)+4H2O(l) △H= -1135. 7kJ/mol
B. 2N2H4 (g) +2NO2(g)=3N2(g)+4H2O(g) △H= -1000. 3kJ/mol
C. N2H4 (g) +NO2 (g)=3/2N2 (g) +2H2O(l) △H = -1135. 7kJ/mol
D. 2N2H4 (g) +2NO2 (g)=3N2 (g) +4H2O(g) △H = -1135. 7kJ/mol
参考答案:D
本题解析:
本题难度:一般
5、选择题 已知在25℃时:2C(s)+O2(g)=2CO(g)△H1=-222kJ/mol,2H2(g)+O2(g)=2H2O(g)△H2=-484kJ/mol, C(s)+O2(g)=CO2(g) △H3=-394kJ/mol,则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为( )
A.-82kJ/mol
B.-41kJ/mol
C.-312kJ/mol
D.+82kJ/mol