微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) 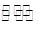 CH3OH(g)△H=
CH3OH(g)△H=
参考答案:
本题解析:
本题难度:困难
2、填空题 已知:下列两个热化学方程式:
Fe(s) + 1/2O2(g)  FeO(s)?
FeO(s)? 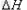 =-272.0KJ/mol
=-272.0KJ/mol
2Al(s) + 3/2O2(g)  Al2O3(s)? ?
Al2O3(s)? ?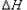 =-1675.7KJ/mol
=-1675.7KJ/mol
则Al(s)的单质和FeO(s)反应的热化学方程式是____________________________________________________。
参考答案:3FeO(s) + 2Al(s)  Al2O3(s) + 3Fe(s)?
Al2O3(s) + 3Fe(s)? 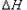 =-859.7KJ/mol
=-859.7KJ/mol
本题解析:
本题难度:一般
3、填空题 (15分)研究碳、氮氧化物的性质与利用具有重要意义。
(1)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是 。
②由MgO制成的Mg可构成“镁——次氯酸盐”电池,其装置示意图如图1,该电池的正极反应式为 ;

(2)化合物甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图2所示:
①甲的化学式是 ;
②图中a、b、c、d四点中,表示反应处于平衡状态的是 。t1~t2时间内v正(乙) v逆(甲)(填“>”“<”或“=”)
③反应进行到t2时刻,改变的条件可能是 。
(3)用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是 。
参考答案:(1)(1)①2MgSO4 + CO 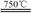 2MgO + SO2 + CO2 + SO3 (2分)
2MgO + SO2 + CO2 + SO3 (2分)
②ClO- + 2e- + H2O = Cl- + 2OH-(2分)
(2)①NO2(2分) ②b (2分) < (2分) ③增大NO2浓度(合理均可,2分)
(3)2H2(g) + 2NO(g) = N2(g) + 2H2O(l) △H = -752.1kJ·mol-1(3分)
本题解析:(1)①750℃时,测得气体中含等物质的量的SO2和SO3,则根据原子守恒可知反应中还有氧化镁和CO2生成,因此此时反应的化学方程式是2MgSO4 + CO 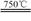 2MgO + SO2 + CO2 + SO3 。
2MgO + SO2 + CO2 + SO3 。
②镁是活泼得金属,镁作负极,失去电子。次氯酸根得到电子,在正极放电,因此该电池的正极反应式为ClO- + 2e- + H2O = Cl- + 2OH-;
(2)①根据图像可知,甲与乙在相同时间内如果甲增加0.4mol/L,乙减少0.4mol/L—0.2mol/L=0.2mol/L,所以甲是NO2,乙是N2O4。
②a、c、d三点中物质得浓度均是变化的,因此一定不是平衡状态。B点物质的浓度不变,说明反应达到平衡状态,所以图中a、b、四点中,表示反应处于平衡状态的是b。t1~t2时间内反应处于平衡状态,则根据方程式N2O4 2NO2可知v正(乙)<v逆(甲)。
2NO2可知v正(乙)<v逆(甲)。
③反应进行到t2时刻,NO2浓度瞬间增大,N2O4浓度逐渐增大,所以改变的条件可能是增大NO2浓度。
(3)已知:①2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1,②2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1,则根据盖斯定律可知①—②即得到用H2催化还原NO消除污染的热化学方程式为2H2(g) + 2NO(g) = N2(g) + 2H2O(l) △H = -752.1kJ·mol-1。
考点:考查原电池、外界条件对平衡状态的影响、平衡状态判断以及盖斯定律的应用
本题难度:困难
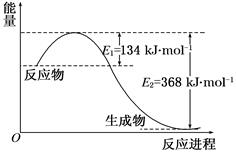
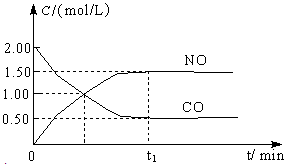
4、填空题 图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
a b
(1)写出NO2和CO反应的热化学方程式 。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)= 。
(3)此温度下该反应的平衡常数K= ;温度降低,K (填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡
参考答案:
本题解析:
本题难度:困难
5、简答题 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
(1)丙烷脱氢可得丙烯.
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ-mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ-mol-1
则相同条件反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=______kJ-mol-1
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol?H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
①反应的热化学方程式为______.
②又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是______kJ.
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______.
参考答案:(1)①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ?mol-1
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ?mol-1
依据盖斯定律①-②得到:C3H8(g)→CH3CH=CH2(g)+H2(g)△H=124.2KJ/mol;
故答案为:124.2;
(2)①把0.4mol液态肼和0.8mol?H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量;写出化学方程式,计算1mol肼反应放热640KJ;依据热化学方程式书写方法写出的化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640?kJ?mol-1,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640?kJ?mol-1;
②①N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640?kJ?mol-1
②H2O(l)=H2O(g)△H=+44kJ/mol
依据盖斯定律①-4×②得到N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-816kJ?mol-1
依据热化学方程式计算,16g液态肼与液态双氧水反应生成液态水时放出的热量是404kJ,
故答案为:404;
③产物是氮气和水,生成产物无污染,故答案为:产物不会造成环境污染.
本题解析:
本题难度:一般