微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E五种短周期元素的原子序数依次增大,质子数之和为40,A、D同主族,B、C同周期,A、B组成的化合物为气体,该气体溶于水显碱性,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素.试回答:
(1)写出下列元素符号:A______,B______,D______.
(2)化合物A2C的电子式是______;请用电子式表示化合物D2C的形成过程______.
(3)E单质与Fe和稀硫酸构成的原电池中,Fe是______极,另外一个电极上的电极反应为______.
(4)将D单质投入A2C中的离子方程式为______.
参考答案:A、B、C、D、E五种短周期元素的原子序数依次增大,质子数之和为40,A、D同主族,B、C同周期,A、B组成的化合物为气体,该气体溶于水显碱性,则该化合物是NH3,A的原子序数小于B,则A是H元素、B是N元素;
A和D同一主族,则D的原子序数大于B,所以D是Na元素;
A、C能形成两种液态化合物A2C和A2C2,C的原子序数大于B而小于D,则C是O元素;
E是地壳中含量最多的金属元素,则E是Al元素;
(1)通过以上分析知,A是H元素、B是N元素、D是Na元素,故答案为:H;N;Na;
(2)化合物H2O的电子式是 ;D2C是Na2O,电子式表示化合物Na2O的形成过程
;D2C是Na2O,电子式表示化合物Na2O的形成过程 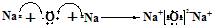 ,故答案为:
,故答案为: ;
;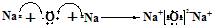 ;
;
(3)Al单质与Fe和稀硫酸构成的原电池中,Al易失电子作负极、Fe作正极,负极上电极反应式为,故答案为:Al-3e-=Al3+,故答案为:正;Al-3e-=Al3+;
(4)D是Na,A2C是水,二者反应生成氢氧化钠和氢气,所以离子方程式为2Na+2H2O═2Na++2OH-+H2↑,
故答案为:2Na+2H2O═2Na++2OH-+H2↑.
本题解析:
本题难度:一般
2、选择题 若有?116?号元素,则该元素应位于第?VIA.假设?IUPAC(?国际纯粹与应用化学会?)?推荐该元素?的符号为?Ch.下列关于?Ch?的说法正确的是( )
A.Ch原子核外的电子层数为7,是金属元素
B.Ch是超铀元素,其原子的质量数为116
C.Ch的氧化物有两种,即Ch02和Ch03,该元素的钠盐的化学式为Na2Ch
D.Ch的最高价氧化物对应的水化物是强酸
参考答案:A.第六周期的稀有气体的原子序数为86,则116-86=30,30-14=16,位于第7周期第ⅥA族,电子层数为7,为金属元素,故A正确;
B.其原子的质子数为116,质量数等于质子数+中子数,故B错误;
C.ⅥA族元素有+4、+6价,则Ch的氧化物有两种,即Ch02和Ch03,为金属元素,则不与钠元素形成盐,故C错误;
D.Ch为金属,则Ch的最高价氧化物对应的水化物显碱性,故D错误;
故选A.
本题解析:
本题难度:简单
3、填空题 下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族
周期 | IA | | 0
1
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
①
②
③
3
④
⑤
⑥
⑦
⑧
4
⑨
|
(1)写出⑧的原子核外电子排布式______?写出⑤的离子核外电子排布式______
(2)在这些元素中,化学性质最不活泼的是:______(填具体元素符号,下同)
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是______,碱性最强的化合物的电子式是:______;
(4)用电子式表示元素④和⑥的化合物的形成过程:______,此化合物属于______(填“共价”或者“离子”)化合物.
(5)表示①与③的化合物的电子式______,该化合物的共价键类型是______
(6)由③和④按原子个数比1:1形成的化合物的电子式是______;该化合物的化学键类型是______.
参考答案:,①为C元素,②为N元素,③为O元素,④为Na元素,⑤为Al元素,⑥为S元素,⑦为Cl元素,⑧为Ar元素,⑨为K元素,则
(1)⑧为Ar元素,原子序数为18,电子排布式为1s22s22p63s23p6,⑤为Al元素,离子核外有10电子,电子排布式为1s22s22p6,故答案为:1s22s22p63s23p6;1s22s22p6;
(2)在这些元素中,Ar原子最外层电子数为8,处于稳定结构,性质稳定,为最不活泼元素,故答案为:Ar;
(3)元素的非金属性最强的是Cl元素,对应的最高价氧化物的水化物HClO4酸性最强,金属性最强的是为K,对应的最高价氧化物的水化物KOH的碱性最强,电子式为
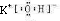
,故答案为:HClO4;
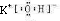
;
(4)元素④和⑥的化合物为Na2S,为离子化合物,含有离子键,用电子可表示形成过程为

,故答案为:

;离子;
(5)①与③的化合物为CO2,为共价化合物,分子中含有极性共价键,电子式为

,
故答案为:

;极性共价键;
(6)③和④按原子个数比1:1形成的化合物为Na2O2,为离子化合物,含有离子键和共价键,电子式为

,
故答案为:

;离子键和共价键.
本题解析:
本题难度:一般
4、选择题 下图中每条折线表示周期表ⅥA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
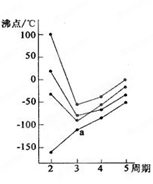
A.H2S
B.HCl
C.PH3
D.SiH4
参考答案:D
本题解析:分析图像,发生转折性 变化的是N、O、F所在的主族,因为氢键的缘故,使沸点反常的高,所以a点所在曲线代表碳族元素的沸点变化,随相对分子质量增大,沸点升高,则a点为SiH4的沸点,答案选D。
本题难度:一般
5、选择题 下列化学用语正确的是( )
A.氯化钙的化学式:CaCl
B.NaCl的电子式: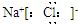
C.乙烯的分子式:CH2═CH2
D.乙醇的结构简式:C2H6O
参考答案:A.氯化钙的化学式为CaCl2,故A错误;
B.NaCl的电子式为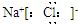 ,故B正确;
,故B正确;
C.乙烯的分子式为C2H4,其结构简式为CH2═CH2,故C错误;
D.乙醇的结构简式为C2H5OH,分子式为C2H6O,故D错误;
故选B.
本题解析:
本题难度:一般