微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在Fe3++3H2O ?Fe(OH)3+ 3H+的平衡体系中,要使平衡向水解方向移动且使溶液的pH值增大,可采取的措施为(?)
A.加热
B.通HCl气体
C.加入FeCl3(固体)
D.加入CuO(固体)
2、填空题 (9分)不同金属离子在溶液中完全沉淀时,溶液的pH不同。?
溶液中被沉淀的离子
| Fe3+
| Fe2+
| Cu2+
|
完全生成氢氧化物沉淀时,溶液的pH
| ≥3.7
| ≥6.4
| ≥4.4
|
氯化铜晶体(C uCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。?
uCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。?
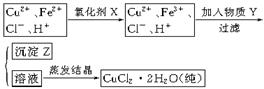
⑴下列氧化剂中最适合作氧化剂X的是?(填序号);
A.NaClO? B.H2O2? C.KMnO4? D. HNO3
⑵物质Y的化学式是?;
⑶写出沉淀Z在水中的沉淀溶解平衡方程式:?。
3、选择题 能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是
①稀释时,溶液中c(OH-)增大 ②溶液的pH<7 ③溶液中c(Na+)=c(A2-) ④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
A.①②③④
B.①③④
C.①③
D.②④
4、简答题 (20分) Ⅰ.(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为?;
生成0.1molK2FeO4转移的电子的物质的量?mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的负极反应式为?。充电时电解液的pH?(填“增大”“不变”或“减小”)。
Ⅱ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH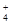 )?(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
)?(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH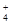 )。
)。
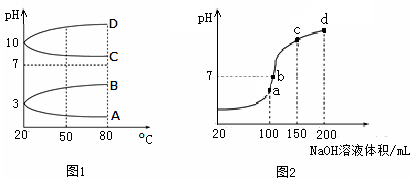
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是?(填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO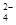 )-c(NH
)-c(NH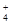 )-3c(Al3+)=?mol·L-1。
)-3c(Al3+)=?mol·L-1。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是?;在b点,溶液中各离子浓度由大到小的排列顺序是?。
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)。当溶液pH=5时,某溶液中的
Al3+?(填“能”或“不能”)完全沉淀(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
5、选择题 常温常压下,将amolCO2气体通入1L1mol/L的NaOH溶液中,下列对所得溶液的描述不正确的是
A.当a=0.5时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
B.当0.5<a<1时,所得溶液中存在:c(Na+)>c(CO32-)+ c (HCO3-)+ c (H2CO3)
C.当a=1时,所得溶液中存在:c(CO32-)+c(OH-)= c (H+)+ c (H2CO3)
D.当a=1时,所得溶液中存在:c(Na+)> c (CO32-)>c(HCO3-)>c(OH-)>c(H+)