微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在Fe3++3H2O ?Fe(OH)3+ 3H+的平衡体系中,要使平衡向水解方向移动且使溶液的pH值增大,可采取的措施为(?)
A.加热
B.通HCl气体
C.加入FeCl3(固体)
D.加入CuO(固体)
参考答案:D
本题解析:本题为Fe3+的水解平衡,升高温度、减小浓度会使平衡右移。A加热使平衡右移H+浓度增大,pH减小;B能入HCl气体导致酸性增强,平衡左移,pH减小;C会增加Fe3+浓度,导致H+浓度增大,pH减小;D中CuO可消耗H+使平衡右移,同时pH值增大,故答案为D。
本题难度:一般
2、填空题 (9分)不同金属离子在溶液中完全沉淀时,溶液的pH不同。?
溶液中被沉淀的离子
| Fe3+
| Fe2+
| Cu2+
|
完全生成氢氧化物沉淀时,溶液的pH
| ≥3.7
| ≥6.4
| ≥4.4
|
氯化铜晶体(C uCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。?
uCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。?
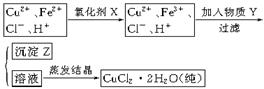
⑴下列氧化剂中最适合作氧化剂X的是?(填序号);
A.NaClO? B.H2O2? C.KMnO4? D. HNO3
⑵物质Y的化学式是?;
⑶写出沉淀Z在水中的沉淀溶解平衡方程式:?。
参考答案:(1)B
(2)CuO(或Cu(OH)2、CuCO3)
(3)Fe(OH)3(S)=Fe3+(aq)+3OH-(aq)
本题解析:略
本题难度:一般
3、选择题 能说明0.1 mol·L-1的NaHA溶液一定呈酸性的是
①稀释时,溶液中c(OH-)增大 ②溶液的pH<7 ③溶液中c(Na+)=c(A2-) ④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应
A.①②③④
B.①③④
C.①③
D.②④
参考答案:C
本题解析:①分析知NaHA溶液不可能呈中性,溶液呈碱性(或酸性),稀释时溶液的碱性(或酸性)都应该减弱,现溶液中c(OH-)增大,则溶液中c(H+)减小,酸性减弱,故溶液呈酸性;②因温度不确定,故pH<7的溶液不一定呈酸性;③溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),现c(Na+)=c(A2-),故c(H+)=c(OH-)+c(HA-)+c(A2-),所以溶液中c(H+)>c(OH-),溶液呈酸性;④NaHA+NaOH=Na2A+H2O,两者1:1能恰好反应,但并不能确定NaHA溶液呈酸性还是碱性。
本题难度:一般
4、简答题 (20分) Ⅰ.(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为?;
生成0.1molK2FeO4转移的电子的物质的量?mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的负极反应式为?。充电时电解液的pH?(填“增大”“不变”或“减小”)。
Ⅱ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 91Exam.org mol·L-1NH4Al(SO4)2中c(NH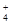 )?(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
)?(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH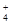 )。
)。
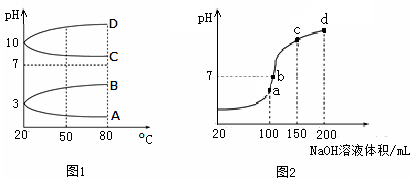
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是?(填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO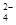 )-c(NH
)-c(NH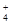 )-3c(Al3+)=?mol·L-1。
)-3c(Al3+)=?mol·L-1。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是?;在b点,溶液中各离子浓度由大到小的排列顺序是?。
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)。当溶液pH=5时,某溶液中的
Al3+?(填“能”或“不能”)完全沉淀(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
参考答案:(20分)
Ⅰ、(1)2Fe(OH)3 + 3KClO + 4KOH = 2K2FeO4 + 3KCl + 5H2O (2分)? 0.3 (2分)
(2)Zn + 2OH- - 2e- = Zn(OH)2 (2分)?减小(2分)
Ⅱ、(1) 小于? (2分)? (2)①A? (2分)? ②10-3-10-11?(2分) ?
(3)a (2分) ?c(Na+)>c(SO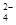 )>c(NH
)>c(NH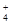 )>c(OH-)=c(H+)?(2分) ?
)>c(OH-)=c(H+)?(2分) ?
(4)能 (2分)
本题解析:Ⅰ、(1)KClO在KOH存在条件下,把Fe(OH)3氧化为K2FeO4,同时生成KCl、H2O,根据化合价升降法配平可得化学方程式:2Fe(OH)3 + 3KClO + 4KOH = 2K2FeO4 + 3KCl + 5H2O;根据Fe元素化合价变化可得:K2FeO4 ~ 3e?,所以生成0.1molK2FeO4转移的电子的物质的量为0.3mol。
(2)放电时电池的负极发生氧化反应,元素化合价升高,根据总方程式可得放电时电池的负极反应式为:Zn + 2OH- - 2e- = Zn(OH)2,根据化学方程式,充电时消耗KOH,所以充电时电解液的pH减小。
Ⅱ、(1) NH4HSO4为强酸的酸式盐,电离出的H+抑制NH4+的水解,所以相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH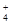 )小于 0.1 mol·L-1NH4HSO4中c(NH
)小于 0.1 mol·L-1NH4HSO4中c(NH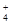 )。
)。
(2)①NH4Al(SO4)2中NH4+和Al3+水解使溶液显酸性,温度升高,水解程度增大,pH减小,故符合0随温度变化的曲线为A。
②根据示意图可知:20℃时,0.1 mol·L-1NH4Al(SO4)2pH为3,则c(H+)=10-3mol?L?1,c(OH?)= 10-11mol?L?1,根据电荷守恒可得:c(H+)+c(NH4+)+3c(Al3+)=c(OH?)+2c(SO42?),所以2c(SO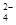 )-c(NH
)-c(NH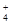 )-3c(Al3+)=c(H+)—c(OH?)= 10-3-10-11
)-3c(Al3+)=c(H+)—c(OH?)= 10-3-10-11
(3)a点显酸性,NH4+、Al3+水解,促进了H2O的电离,b点为中性,没有其它离子干扰,c、d显碱性,NaOH过量,抑制了H2O的电离,所以水的电离程度最大的是a;b点为中性,c(H+)=c(OH?),根据电荷守恒,c(Na+)+c(NH4+)=2c(SO42?),溶液显中性,NaOH应稍过量,抵消NH4+水解产生的H+,所以离子浓度由大到小顺序为:c(Na+)>c(SO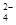 )>c(NH
)>c(NH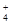 )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
(4)溶液的pH=5,则c(OH?)=10-9mol?L?1,带入c(Al3+)?c3(OH?)= 2.0×10-33,解得c(Al3+)= 2.0×10-6mol?L?1,所以Al3+完全沉淀。sp的应用。
本题难度:一般
5、选择题 常温常压下,将amolCO2气体通入1L1mol/L的NaOH溶液中,下列对所得溶液的描述不正确的是
A.当a=0.5时,所得溶液中存在:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
B.当0.5<a<1时,所得溶液中存在:c(Na+)>c(CO32-)+ c (HCO3-)+ c (H2CO3)
C.当a=1时,所得溶液中存在:c(CO32-)+c(OH-)= c (H+)+ c (H2CO3)
D.当a=1时,所得溶液中存在:c(Na+)> c (CO32-)>c(HCO3-)>c(OH-)>c(H+)
参考答案:D
本题解析:A选项a=0.5,只生成了0.5mol碳酸钠,发生水解,溶液中离子c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)正确。B中二氧化碳过量,碳酸钠与碳酸氢钠共存,而碳酸钠的量大于碳酸氢钠,c(Na+)>c(CO32-)+ c (HCO3-)+ c (H2CO3)正确。C和D选项中全部生成了碳酸氢钠,而水解大于电离,所以正确的离子排序应该为c(HCO3-) > c (CO32-),D错。
点评:本题考查了二氧化碳通入氢氧化钠的一系列变化,涉及少量简单计算,属于简单题。
本题难度:一般