微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (6分)某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数。可供选用的试剂有:浓H2SO4、浓硝酸、6 mol·l-1 NaOH溶液。
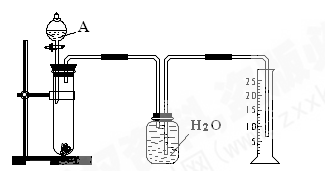
请填写下列空白:
(1)有关实验操作:a、往试管中放入适量的铝合金样品;b、从分液漏斗往试管中加入过量的A溶液;c、检查装置的气密性;d、测定收集到的水的体积。
正确的操作顺序为_________________________________________。
(2)A溶液可选用________________________________________
(3)若实验中测得样品的质量为W g ,氢气的体积为a L(标准状况),则样品中Al的质量分数为_______________________________________。
参考答案:

本题解析:略
本题难度:一般
2、实验题 (共7分)欲配制 250 mL0.1 mol·L-1的NaOH溶液,回答下列问题:
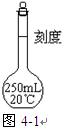
(1)写出图4-1仪器的名称??,使用此仪器前要检查它是否?。
(2)用托盘天平称取NaOH固体的质量?g。
(3)转移溶液时,应将已冷却的NaOH溶液沿??注入右图所示的仪器中。
(4)若称量前NaOH已部分潮解,则配制的溶液的浓度?(偏大或偏小)。
(5)在配制该NaOH溶液时必须用到的实验仪器是(填序号)?。(2分)
①500mL的量筒 ②烧杯 ③托盘天平 ④250mL的容量瓶 ⑤玻璃棒
⑥1000mL的容量瓶 ⑦胶头滴管 ⑧250mL的量筒
参考答案:(1)容量瓶,漏水;(3)玻璃棒;(4)偏小
(2)1.0; (5)②③④⑤⑦
本题解析:略
本题难度:一般
3、选择题 下列有关实验操作的说法正确的是(?)
A.SO2通入酸性高锰酸钾溶液中,溶液褪色,说明SO2具有漂白性
B.用蒸馏水将PH试纸先润湿,可用于检验氨气
C.可用瓷坩埚熔化各种钠的化合物
D.某溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
参考答案:B
本题解析:A.SO2通入酸性高锰酸钾溶液中,溶液褐色,是由于二氧化硫将高锰酸钾还原为硫酸锰,致使其褪色,表现了二氧化硫的还原性:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
B.氨气为碱性气体,可使润湿的pH试纸呈蓝色
C.瓷坩埚中的二氧化硅可与强碱(NaOH)反应:SiO2+2NaOH=Na2SiO3+H2O
D.若原溶液中含有SO32-离子,加Ba(NO3)2溶液,再加入稀盐酸,依然可得到不溶于酸的BaSO4沉淀(NO3—在酸性溶液中可将SO32-离子氧化为SO42-,进而生成BaSO4沉淀),故错误
答案为B
本题难度:一般
4、实验题 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:
①?BrO3-?+?6I-?+?6H+?=?3I2?+?Br-+?3H2O?
②?2BrO3-?+?I2?=?2IO3-?+?Br2
③?IO3-?+?5I-?+?6H+?=?3I2?+?3H2O?
④?2IO3-?+?10Br-+?12H+?=?I2?+?5Br2?+?6H2O
实验如下:?
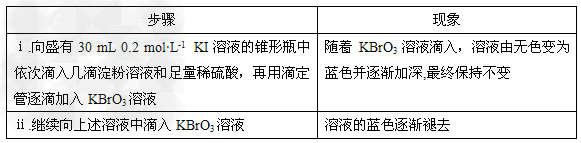
请回答:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移__________mol?e-,该反应中硫酸表现出的化学性质是____________。
(2)上述资料中的反应____________(填序号)可表示步骤ⅱ中的反应,通过该反应_______________(填“能”或“不能”)说明碘的非金属性强于溴,原因是_______________。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是_____________;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是________________。
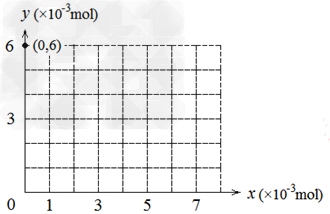
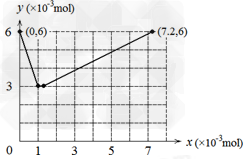
(4)若用y表示锥形瓶中含碘物质的物质的量?,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。?
参考答案:(1)0.006 ;酸性
(2)② ;不能 ;?该反应只能说明I2的还原性比Br2强
(3)BrO3-?>?IO3-?>?Br2?>?I2 ;BrO3-?+?5Br-?+?6H+?=?3Br2?+?3H2O
(4)
本题解析:
本题难度:一般
5、实验题 (10分)请你参与下列探究:
[问题情景]某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出。同学们都能解释红色固体物质的出现,请你写出生成红色固体物质的化学反应方程式?。但却对气体的生成产生了疑问,这激发了同学们强烈的探究欲望,生成的是什么气体?
[提出猜想]从物质组成元素的角度,放出的气体可能是O2、SO2、H2。
[查阅资料]SO2易溶于水,它能与过量的NaOH溶液反应,生成Na2SO3。
[方案设计]依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则较简单的检验方法是?。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与过量的NaOH溶液反应的化学方程式?。
(3)甲、乙同学实验的结果表明气体中既不含O2也不含SO2。丙同学根据以上实验结果推测气体是H2。
[实验探究]丙同学为了检验H2,收集了一试管气体,用拇指堵住试管口且管口略向下倾斜靠近火焰移开拇指点火,听到很小的声音。然后再将气体用带尖嘴的导管导出点燃且用冷而干燥的烧杯罩在火焰上方,气体在空气中安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热。
结论:铁粉与硫酸铜的溶液反应时,产生的气体是?。
[思维拓展]由上述实验可以推出,硫酸铜溶液中可能含有?物质。
参考答案:[问题情景] Fe+CuSO4=FeSO4+Cu
[方案设计](1)用带火星的木条检验气体能否使之复燃?(2)SO2+2NaOH=Na2CO3+H2O
[实验探究] H2
[思维拓展]酸性
本题解析:(1)铁的金属性强于铜,能和硫酸铜反应置换出铜,方程式为Fe+CuSO4=FeSO4+Cu。
(2)经验氧气最简单的方法是用带火星的木条,是木条复燃的是氧气。
(3)SO2是酸性氧化物,能和氢氧化钠溶液反应,方程式为SO2+2NaOH=Na2CO3+H2O。
(4)根据反应中的现象可以判断,该气体是氢气。由于铁是活泼的金属能和酸反应产生氢气,这说明溶液中含有酸性的物质。
本题难度:一般