微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 高铁酸钾是一种高效的多功能水处理剂,具有氧化、吸附、絮凝、、助凝、杀菌、除臭等作用,高铁酸钾的开发和利用正日益显示出其广阔的应用前景。其制备流程如下:
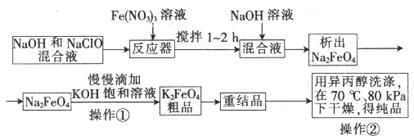
试回答下列问题
(1)反应器中,NaOH、NaClO、Fe(NO3)3发生反应生成Na2FeO4,完成并配平下列离子反应方程式:
□Fe3++□ClO─+□OH─ ==□FeO42─+□Cl─+□___________
(2)次氯酸钠浓度对高铁酸钾产率有一定影响,当NaClO浓度为298g/L时,高铁酸钠的产率最高,此时NaClO的物质的量浓度为_______________。
(3)你认为操作①能够发生转化的原因是__________,慢慢滴加的原因的是___________。
(4)操作②如果温度过高会造成高铁酸钾的分解,高铁酸钾受热分解时生成金属氧化物和氧气,该反应的化学方程式为__________________。
(5)可以用电化学法制取Na2FeO4,其装置如图所示,则阳极的电极反应式为?;
阴极的电极反应式为______________;电解一段时间后溶OH─的浓度会_________(填“升高”、“降低”
或“不变”)。
2、实验题 某同学想通过比较两种最高价氧化物水化物的酸性强弱来验证硫与碳的非金属性的强弱,他采用了下图所示的装置。
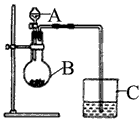
请回答:
(1)仪器A的名称是___________ ,应盛放下列药品中的_____________ 。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是___________ ,应盛放下列药品中的_____________ 。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中应盛放的药品是______________ ,如果看到的现象是____________ ,证明B中发生反应生成了___________ ,即可说明____________比____________酸性强。 B中发生反应的离子方程式为___________ 。
3、实验题 一定量的浓H2SO4与足量的Zn充分反应时,有SO2和H2生成。某校化学研究性学习小组对此进行研究。

按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生,随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又显著增加。试回答:
(1)装置A中需要用浓H2SO4,请用一种简单的方法确定一瓶H2SO4是浓H2SO4:_______________。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____、______接b,c接________、________接d。
(3)证明浓H2SO4具有强氧化性的实验现象为________________;反应较长时间后气泡又明显增加的原凶是________________。
(4)D中浑浊消失的离子方程式为_____________________。
(5)若要证明SO2具有还原性,C中的药品应该是_______________。
4、实验题 在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”时,请设计一种简便的判断方法。
5、填空题 某化学实验小组同学用如图所示装置进行系列实验,以探究气体的性质(部分仪器已略去).请回答:
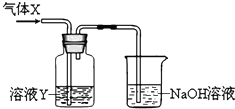
(1)若气体X为氯气,溶液Y为含有少量KSCN的FeCl2溶液,则可观察到溶液Y中的实验现象是______反应的离子方程式为
______;NaOH溶液中发生反应的离子方程式是______
(2)若溶液Y为品红溶液,气体X通过后,溶液褪色,取少量褪色后的溶液加热后恢复为红色,则气体X可能是______(填化学式).