微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuSO4?5H2O及CaCO3,步骤如下:
请回答下列问题:
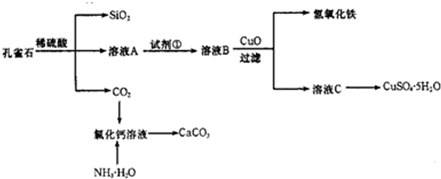
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+.从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为______(填代号).
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4?5H2O,需要经过加热蒸发、______、过滤等操作.过滤时为了防止滤液飞溅,应______.
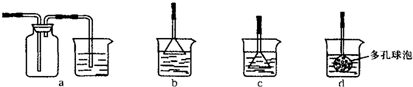
(3)制备CaCO3时,若实验过程中有氨气逸出,应选用下列______装置吸收(填代号).
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液进行氧化还原滴定,配制时等液面接近容量瓶刻度线时,应该继续进行的操作是______.滴定时需要用用KMnO4标准溶液润洗滴定管,润洗后的废液应从酸式滴定管的______排出.
参考答案:(1)由溶液B加入CuO可生成氢氧化铁沉淀可知,B应为含Fe3+的溶液,则试剂①应将Fe2+氧化为Fe3+,为不引入新的杂质,可用H2O2为氧化剂,可用KSCN检验Fe3+,
故答案为:c;d;
(2)由溶液制取晶体,需经过加热浓缩,冷却结晶才可得到,过滤时为了防止滤液飞溅,应使漏斗下端玻璃管与烧杯壁紧靠,
故答案为:冷却结晶;使漏斗下端玻璃管与烧杯壁紧靠;
(3)氨气极易溶于水,且氨气有刺激性气味,防止污染大气,要有尾气处理装置,选用倒置的漏斗且紧贴水面,目的是防止倒吸,
故答案为:b;
(4)配制溶液时要进行定容,可用胶头滴管向容量瓶中滴加蒸馏水,至溶液的凹液面正好与刻度线相平,润洗滴定管时,为充分润洗,应将润洗液从下口排出,
故答案为:用胶头滴管向容量瓶中滴加蒸馏水,至溶液的凹液面正好与刻度线相平;下口.
本题解析:
本题难度:一般
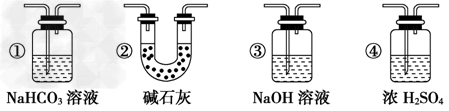
2、推断题 某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。

(1)写出装置A中发生反应的离子方程式:_________________________________。
(2)装置D中黑色固体为_______(填名称),反应的化学方程式为:_________________。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:__________________________________________________________。
(4)按照如图装置进行实验时,首先进行的操作名称是?_____________。
(5)根据实验中的_____________现象,可证明CO具有还原性,有关反应的化学方程式是 ___________________________。
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置_______与_____之间连接下图中的________装置(填序号)。
参考答案:(1)CaCO3+2H+===Ca2++H2O+CO2↑ ?
(2)炭;C+CO2 2CO
2CO
(3)没有除去气体中的水蒸气,高温下水蒸气与炭反应生成H2和CO,H2也能还原CuO
(4)检查装置的气密性
(5)E装置中黑色固体变成红色;CuO+CO Cu+CO2
Cu+CO2
(6)D;E;②
本题解析:
本题难度:一般
3、填空题 单质碘有非常重要的用途,它的制备一般有两种方法:
方法一:海带、海藻燃烧后所得的灰份中含I-,从中获得I-,由I-制备I2.
某研究性学习小组为了从海带中提取碘,设计并进行了以下实验:

请回答:
(1)步骤①中灼烧海带用到的实验仪器有坩埚钳、铁三脚架、泥三角、酒精灯和______(填字母).
A.试管B.瓷坩埚C.烧杯D.量筒
(2)步骤③的实验操作名称是______;
(3)步骤④中氧化剂最好选用______(填字母)
A.浓硫酸B.新制氯水
C.酸性KMnO4溶液D.3%H2O2溶液和稀H2SO4混合液
其反应的离子方程式是______.
(4)步骤⑤中,学生选择用苯来提取碘,还可以用下列______(填字母)来提取碘.
A.乙酸B.四氯化碳C.酒精D.己烷
(5)步骤⑤中,为了检验提取碘后的水溶液中是否还含有单质碘,取少量上述溶液于试管中,滴加______,如果看到______,则证明溶液中还含有碘.
(6)步骤⑤中为了得到含碘苯溶液,某学生设计了以下操作步骤:
a.将含碘的水溶液置于分液漏斗中
b.加入适量的苯
c.分离出下层液体
d.分离出上层液体,即得到含碘苯溶液
以上设计中有遗漏的操作.应该在步骤______(填字母)后,增加操作:______.
方法二:从智利硝石中获得碘酸钠(NaIO3),再用NaHSO3把碘酸钠还原为I2.实际生产中分两步进行:
第一步:先用适量的NaHSO3将碘酸钠还原成I-,反应的离子方程式为:
IO3-+3HSO3-=I-+3SO42-+3H+;
第二步:向所得的酸性I-溶液中加入适量的碘酸钠(NaIO3)溶液便有碘析出,反应的离子方程式为______.
参考答案:方法一、(1)固体的灼烧应在坩埚中进行,实验仪器有坩埚钳、铁三脚架、泥三角、酒精灯和瓷坩埚,
故答案为:B;
(2)由悬浊液得到溶液,应进行过滤,故答案为:过滤;
(3)步骤④中选择氧化剂时,要考查尽量不引入新的杂质,可选用3%H2O2溶液和稀H2SO4混合液,反应的离子方程式为2I-+H2O2+2H+═I2+2H2O,
故答案为:D;2I-+H2O2+2H+═I2+2H2O;
(4)乙酸和酒精与水混溶,不能用作萃取剂,四氯化碳和己烷不溶于水,且碘在二者中的溶解度较大,可用作萃取剂,故答案为:B、D;
(5)淀粉与碘变蓝色,在溶液中加入四氯化碳振荡后,溶液分层,且下层为紫红色,则可用淀粉或四氯化碳检验,
故答案为:淀粉溶液;溶液变蓝;或CCl4;分层,下层呈紫红色;
(6)萃取时,加入萃取剂之后,应充分振荡,使碘和萃取剂充分接触、溶解,达到萃取的目的,
故答案为:b;将分液漏斗充分振荡后静置;
方法二、IO3-与I-在酸性条件下可发生氧化还原反应生成I2,反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O.
本题解析:
本题难度:一般
4、选择题 下列实验能获得成功的是(?)
A.苯和浓溴水用Fe作催化剂制溴苯
B.氯乙烷与NaOH溶液共热,水解后加入AgNO3溶液检验Cl-
C.CH4和Cl2光照制得纯净的CH3Cl
D.乙烯通入含Br2的CCl4溶液制得CH2BrCH2Br
参考答案:D
本题解析:略
本题难度:简单
5、实验题 某校课外小组为了探究铜与稀硝酸反应产生的是NO而设计了一个实验。其装置如下图加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空的注射器,D是尾气处理装置。请回答有关问题:
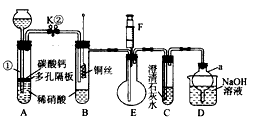
(1)如何检查装置A的气密性_______________________________。
(2)设计装置A的目的是____;为达此目的,应如何操作____________________________________________________________________________。
(3)在(1)中的“操作”后将装置B中铜丝插入稀硝酸并微热,观察到装置B中的现象是_______________;B中反应的离子方程式是______________________________________。
(4)装置E和F的作用是_____________________________;为验证实验此作用,其操作方法和现象是________________________________。
(5)D部分仪器a的作用是__________________________。
参考答案:(1)关闭K,向长颈漏斗中加水至漏斗下端中形成一段液柱,静置 一段时间,若液面高度保持不变,则气密性良好
(2)利用生成的CO2气体将装置中的空气除尽;打开K,将CO2气体通入至C中产生白色沉淀时,关闭K
(3)铜丝上产生气泡,溶液逐渐变蓝;3Cu+8H++2NO3- =3Cu2++2NO↑+4H2O
(4)验证无色气体为NO;推动注射器,将F中空气通入E中,无色气体变红
(5)防止液体倒吸
本题解析:
本题难度:一般