微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应aX(g)+bY(g)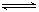 cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率( υ)一时间(t)图象如下图。则下列说法中正确的是
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率( υ)一时间(t)图象如下图。则下列说法中正确的是

A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是加入了催化剂
D.若a+b≠c,则t0时只能是增大了容器的压强
参考答案:C
本题解析:若a+b=c,反应前后气体的物质的量不变,增大压强,正、逆反应速率同等倍数的增大,化学平衡不移动,使用催化剂也是同等倍数的增大正、逆反应速率,都符合图像;若a+b≠c,增大压强,平衡向气体体积减小的方向移动,化学平衡移动,只有加入催化剂才符合图像,故C项正确。
本题难度:一般
2、填空题 (14分)合成气是以H2、CO等为主要组成的供化学合成的原料气,回答有关问题:
(1)甲烷在一定条件下与水反应可得合成气,该反应中每转移1.2mol电子,所得合成气在表况下的体积为 L。
(2)合成气在合成氨气时需除去CO,可利用以下反应: CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g) 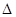 H=-41.16kJ/mol,对于该反应有关表述正确的是 。
H=-41.16kJ/mol,对于该反应有关表述正确的是 。
a.其他条件不变,缩小体系体积增大压强时反应速率不变,所以平衡不移动
b.绝热条件下,若测得该体系温度不再改变,则反应处于平衡状态
c.温度升高,该反应平衡常数增大
d.为提高CO转化率,可适当增加水蒸气用量
某温度下,H2O和CO按体积比5:l充入某恒容反应器,平衡时测得CO与CO2体积比l:9,则该条件下的平衡常数为 (保留两位有效数字)
(3)为除去(2)中生成的CO2,可用碳酸钾溶液吸收,常温下pH=10的碳酸钾溶液中水电离的OH- 的物质的量浓度为 ,碳酸氢钾溶液中离子浓度大小顺序为
(4)CO2和NH3在一定条件下反应生成尿素[CO(NH2)2]:CO2(g)+2NH3(1)=H2O(1)+CO(NH2)2(1),CO2的转化率随温度变化曲线如下,则该反应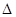 H 0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
H 0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。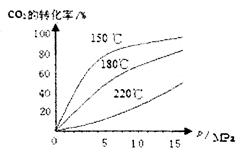
参考答案:(14分,每空2分)(1)17.92L
(2)b d 2.0
(3)10-4mol/L [K+]>[HCO3]>[OH]>[H+]
(4)< 净化后重新充入合成塔内,循环利用,提高原料利用率
本题解析:(1)甲烷在一定条件下与水反应的方程式为CH4+H2O→CO+3H2,即每生成4mol气体反应中就转移6ml电子。反应中每转移1.2mol电子,所得合成气在标准状况下的体积为 。
。
(2)缩小体系体积增大压强,则反应速率一定会增大,但反应前后气体的体积不变,故改变越强不影响平衡,a不正确。绝热条件下,若测得该体系温度不再改变,说明此时正逆反应速率相等,即达到平衡状态,b正确。正反应放热,温度升高平衡向逆反应方向移动,平衡常数减小,c不正确。增加水蒸气用量虽然可降低自身的转化率,但会提高其它反应物的转化率,d正确。
(3)碳酸钾水解显碱性,促进了水的电离,所以下pH=10的碳酸钾溶液中水电离的OH- 的物质的量浓度为1×10-4mol/L。碳酸氢钾溶液显碱性是因为碳酸氢钾的水解程度大于其电离程度,所以溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
(4)由图像可看出,在等压时温度越高,二氧化碳的转化率越低,所以正反应是放热反应。为了提高原料的利用率,必须循环使用。
本题难度:困难
3、填空题 (16分)为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下:

合成塔中反应的化学方程式为 ;△H<0。从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考 虑温度对反应速率的影响外,还主要考虑了 。
虑温度对反应速率的影响外,还主要考虑了 。
从合成塔分离出甲醇的原理与下列 操作的原理比较相符(填字母)。
A.过滤
B.分液
C.蒸馏
D.结晶
