微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将一定质量铜与100 mL一定浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液加入140 mL 5 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度是
A.5 mol/L
B.7 mol/L
C.10 mol/L
D.12 mol/L
参考答案:D
本题解析:在Cu与硝酸的反应中Cu失去电子变为Cu2+,硝酸得到电子变为NO和NO2混合气体,向反应后的溶液中加入OH-后,发生反应:Cu2++2OH-=Cu(OH)2↓.消耗的OH-的个数与硝酸铜中的硝酸根离子的个数相等。所以反应过程中消耗的硝酸的物质的量为n(HNO3)=n(气体)+n(NO3-)=" 11.2L÷22.4L/mol+" 0.14L×5 mol/L="0." 5mol+0.7mol=1.2mol.所以C(HNO3)=1.2mol÷0.1L=12mol/L.选项为D.
本题难度:一般
2、填空题 过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:
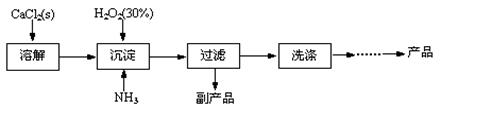
(1)用上述方法制取CaO2·8H2O的化学方程式是?。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
①?;②?。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200mol·L—1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为?。
(4)根据表1数据计算产品中CaO2·8H2O的质量分数(写出计算过程):
滴定次数
| 样品的质量/g
| KMnO4溶液的体积/mL
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 0.3000
| 1.02
| 24.04
|
2
| 0.3000
| 2.00
| 25.03
|
3
| 0.3000
| 0.20
| 23.24
|
?
表1. KMnO4标准溶液滴定数据
参考答案:(1)CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl;(2)①温度低可减少过氧化氢的分解,提高过氧化氢的利用率(或防止过氧化氢的分解);②通入过量的NH3使溶液呈碱性,抑制CaO2·8H2O的溶解(或提高产品的产率);(3)当滴入最后一滴KMnO4标准溶液后由无色变浅红色,且半分钟内不褪色。(4)82.91%? 5 CaO2·8H2O?~?5 H2O?~? 2 KMnO4
n(CaO2·8H2O)=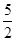 n(KMnO4)=
n(KMnO4)= 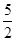 ×0.0200mol/L×23.03mL×10-3L/mL=1.1151×10-3mol,所以CaO2·8H2O的质量分数为:
×0.0200mol/L×23.03mL×10-3L/mL=1.1151×10-3mol,所以CaO2·8H2O的质量分数为: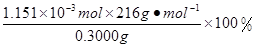 =82.91%
=82.91%
本题解析:(1)根据题意可知:用上述方法制取CaO2·8H2O的化学方程式是CaCl2+H2O2+2NH3+ 8H2O= CaO2·8H2O↓+2NH4Cl。(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3是因为①温度低可减少过氧化氢的分解,提高过氧化氢的利用率;②通入过量的NH3使溶液呈碱性,抑制CaO2·8H2O的溶解(或提高产品的产率)。(3)CaO2+2H2O=Ca(OH)2+H2O2; 2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O.当达到滴定终点时会观察到溶液由无色变为浅红色,半分钟内不褪色。(4)由方程式得关系式为:5CaO2·8H2O ~2KMnO4。消耗的KMnO4溶液的体积为{(24.04-1.02)+( 25.03-2.00)+( 23.24-0.20)}ml÷3=23.03ml.n(CaO2·8H2O)=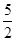 n(KMnO4)=
n(KMnO4)= 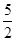 ×0.0200mol/L×23.03mL ×10-3L/mL ="1.1151" ×10-3mol 。所以CaO2·8H2O的质量分数为:
×0.0200mol/L×23.03mL ×10-3L/mL ="1.1151" ×10-3mol 。所以CaO2·8H2O的质量分数为: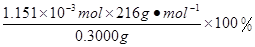 =82.91%。2·8H2O的制备原理及操作注意问题、滴定终点的判断、物质含量的测定的知识。
=82.91%。2·8H2O的制备原理及操作注意问题、滴定终点的判断、物质含量的测定的知识。
本题难度:一般
3、选择题 Cl2通入70℃的某浓度的氢氧化钠水溶液中,能同时发生两个自身氧化还原反应(未配平):NaOH + Cl2 → NaCl + NaClO + H2O,NaOH + Cl2 → NaCl + NaClO3 + H2O。反应完成后测得溶液中NaClO与NaClO3的数目之比为5:2,则该溶液中NaCl与NaClO的数目之比为
A.3∶1
B.2∶1
C.15∶2
D.1∶1
参考答案:A
本题解析:设溶液中NaClO与NaClO3的物质的量分别为5mol、2mol,NaClO与NaClO3均是氯气的氧化产物,转移电子的物质的量=5mol×1+2mol×(5-0)=15mol。氯气的还原产物是氯化钠,则根据电子注意守恒可知NaCl的物质的量=5mol×1+2mol×(5-0)=15mol,因此该溶液中NaCl与NaClO的数目之比为15mol:5mol=3:1,答案选A。
本题难度:一般
4、填空题 (6分)根据反应8NH3 + 3Cl2 ="=" 6NH4Cl + N2 ,回答下列问题:
(1) 还原剂是?(写化学式);
(2) 用双线桥法表示该反应电子转移的方向和数目;?
(3)当反应中转移1.806×1024个电子时,被氧化的气体在标准状况下的体积为?升。
参考答案:(1)NH3;(2分)?(2)略;(2分)?(3)22.4。(2分)
本题解析:略
本题难度:一般
5、选择题 已知氧化还原反应:
2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
其中1 mol氧化剂在反应中得到的电子为(?)
A.10mol
B.11mol
C.12mol
D.13mol
参考答案:B
本题解析:这是一个氧化还原反应,氧化剂所得到的电子数与还原剂所失去的电子数相等,每反应掉2mol的碘酸铜就反应掉24mol的碘化钾,其中作还原剂的碘化钾为22mol,共失去22mol的电子,那么有1mol的氧化剂参加反应时,所得到的电子就为11mol。选B
本题难度:一般