微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 12mL浓度为0.1mol·L-1Na2SO4溶液,恰好与40mL浓度为0.01 mol·L-1K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中得化合价是
A.0
B.+2
C. +3
D.+6
参考答案:C
本题解析:略
本题难度:一般
2、选择题 一定浓度l00mL的HNO3溶液中加入2.8gFe,全部溶解,得到标准状况下的NO气体1.12L,?测得反应后溶液中的c(H+)=0.1mol/L。若反应前后溶液体积变化忽略不计,则下列有关判断错误的是
A.反应后溶液中无硝酸亚铁
B.反应前HNO3溶液的浓度为2.0mol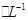
C.反应后溶液中c(NO3-)=1.6mol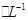
D.反应后的溶液最多还能溶解1.6lgFe
参考答案:B
本题解析:由信息知道反应后硝酸剩余,所以反应后溶液中无硝酸亚铁,A正确;反应前硝酸的物质的量="3×2.8/56+1.12/22.4+0.01=0.15+0.05+0.01=0.21mol." 反应前HNO3溶液的浓度为2.1mol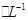 ,所以B错误;反应后溶液中n(NO3-)=" 3×2.8/56+0.01=0.16mol," c(NO3-)=1.6mol
,所以B错误;反应后溶液中n(NO3-)=" 3×2.8/56+0.01=0.16mol," c(NO3-)=1.6mol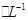 ,C正确;原硝酸能溶解的Fe的最大质量为 0.21mol×3/8×56= 4.41g,故 能再溶解的Fe的质量为4.41g-2.8g=1.61g故D正确( 3 Fe+8HNO3=3Fe(NO3)2 +2 NO↑+4H2O (稀硝酸不足)。
,C正确;原硝酸能溶解的Fe的最大质量为 0.21mol×3/8×56= 4.41g,故 能再溶解的Fe的质量为4.41g-2.8g=1.61g故D正确( 3 Fe+8HNO3=3Fe(NO3)2 +2 NO↑+4H2O (稀硝酸不足)。
本题难度:一般
3、选择题 已知可用Co2O3代替MnO2制备Cl2,反应前后存在六种微粒:Co2O3、H2O、Cl2、H+、Cl-和Co2+。下列叙述不正确的是
A.氧化产物为Cl2
B.氧化剂与还原剂的物质的量之比为1:6
C.若有3mol H2O生成,则反应中有2mol电子转移
D.微粒的还原性Cl->Co2+
参考答案:B
本题解析:反应方程式为:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O,Co2O3中的钴元素由+3价降至+2价,得电子,做氧化剂,还原产物为Co2+;而Cl-失电子,做还原剂,被氧化为氯气,即氧化产物;
氧化剂与还原剂的物质的量之比为1:2,B不正确
反应中有2个电子转移,C正确;
还原剂的还原性强于还原产物的还原性,即:Cl->Co2+
本题难度:一般
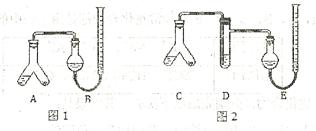
4、填空题 (14分)某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去。提供的试剂:研细的钙片粉末 (钙片中的其他成分不与 盐酸反应)、
盐酸反应)、 盐酸、5%NaOH溶液、饱和
盐酸、5%NaOH溶液、饱和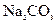 溶液、饱和
溶液、饱和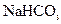 溶液和蒸馏水。
溶液和蒸馏水。
 ?
?
实验过程:
Ⅰ.检查两套装置的气密性。
Ⅱ.在A、C的右边加入0.25g钙片粉末,左边加入3mL 盐酸,塞紧塞子。在B、E中均加入饱和
盐酸,塞紧塞子。在B、E中均加入饱和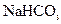 溶液,如图所示,记下量气管读数。
溶液,如图所示,记下量气管读数。
Ⅲ.将A、C倾斜,使液体与固体混合,实验结束并冷却后读出量气管读数,测得B中收集到的气体为41.90mL,E中收集到的气体体积为39.20mL(以上气体体积均已折算为标准状况下的体积)。
回答下列问题:
(1)Ⅰ中检查图1装置气密性的方法是?
?。
(2)A中发生反应的离子方程式为?;
D中加入试剂为?,D的作用是?。
(3)实验前左右两管液 面在同一水平面上,最后读数时右管的液面高于左管的液面,应进行的操作是?
面在同一水平面上,最后读数时右管的液面高于左管的液面,应进行的操作是?
? ?。
?。
(4)图2实验所得钙片中的碳酸钙的质量分数为?;图1实验比图 2实验所得钙片中的碳酸钙含量偏高,用离子万程式表示偏高的原因?
?。
参考答案:
(1)往B中右侧量气管中加水,一段时间后量气装置左右液面差不变,说明气密性良好。
(2)CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O?蒸馏水?吸收挥发出来的氯化氢
(3)向下移动右管,使左右两管液面相平。
(4)70%?HCO3- + H+ = CO2↑ + H2O?(每空2分)
本题解析:略
本题难度:一般
5、填空题 (11分)用KMnO4氧化溶质质量分数为36.5%的盐酸。反应方 程式如下:
程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl 2+ 5Cl 2↑+8H2O
5Cl 2↑+8H2O
⑴此反应中氧化剂是?,氧化产物?。若有1mol KMnO4参加反应,转移电
子的物质的量为?。
⑵15.8g KMnO4完全反应,产生的Cl 2在标准状况下的体积为?,有?molHCl
发生反应,有?molHCl被氧化。
⑶若此盐酸的密度为1.2g/cm3,其物质的量浓度为?。
参考答案:(11分)
⑴KMnO 4? Cl2? 5mol(每空1分)
4? Cl2? 5mol(每空1分)
⑵5.6L? 0.8? 0.5(每空2分)
⑶12mol/L(2分)
本题解析:略
本题难度:一般