微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 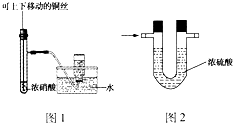 下列有关实验原理或操作正确的是
下列有关实验原理或操作正确的是
A.用分液漏斗从石油中分离出汽油、煤油和柴油
B.用盐酸滴定氨水时,可用甲基橙作指示剂
C.实验室中用图1装置制备并收集少量的NO2
D.实验室中用图2装置除去H2中混有的少量NH3
参考答案:B
本题解析:分析:A.根据汽油、煤油和柴油是互溶的混合物,应通过分馏的方法分离;
B.根据盐酸滴定氨水恰好反应时溶液呈酸性,应选择酸性变色范围内变色的指示剂;
C.根据二氧化氮能与水反应生成一氧化氮和硝酸;
D.根据U形管中装的是液体干燥剂,气体无法通过;
解答:A.汽油、煤油和柴油是互溶的混合物,应通过分馏的方法分离,不能通过分液的方法分离,故A错误;
B.盐酸滴定氨水恰好反应时溶液呈酸性,可用甲基橙作指示剂,故B正确;
C.二氧化氮能与水反应生成一氧化氮和硝酸,所以不能用排水法收集NO2,故C错误;
D.根据U形管中装的是液体干燥剂,气体无法通过,故D错误;
故选:B;
点评:本题主要考查了常见的实验操作,难度不大,掌握实验的原理是解题的关键.
本题难度:一般
2、选择题 实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是
[? ]
A.锥形瓶水洗后,又用待测液润洗
B.滴定管水洗后未用标准液润洗就直接装入标准液
C.滴定过程中,标准液滴到锥形瓶外
D.读滴定管开始时仰视,读终点时俯视
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列图示与对应的叙述不相符的是
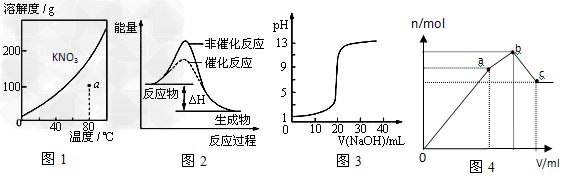
[? ]
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1醋酸溶液得到的滴定曲线
D.图4?表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列实验方法或操作正确的是( )
A.酸碱中和滴定时,右手旋转滴定管的活塞,左手摇动锥型瓶,眼睛注视滴定管中的液面
B.用200mL烧杯配制物质的量浓度约为0.1000mol/L氢氧化钠溶液200mL
C.不用另加任何试剂就能鉴别NaAlO2、Na2SiO3、HCl、NaCl四种无色溶液
D.用托盘天平称取1.6g硫酸铜晶体配制100mL?0.1mol/L的硫酸铜溶液
参考答案:C
本题解析:
本题难度:一般
5、简答题 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是______.
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为______mL,终点读数______mL;
(3)某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL)
滴定前刻度
滴定后刻度
溶液体/mL
第一次
25.00
0.00
26.11
26.11
第二次
25.00
1.56
30.30
28.74
第三次
25.00
0.22
26.31
26.09
|
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=______.

参考答案:(1)A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=c(标准)×V(标准)V(待测)可知,测定c(NaOH)偏大,故A错误;
B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=c(标准)×V(标准)V(待测)可知,测定c(NaOH)无影响,故B错误;
C、酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=c(标准)×V(标准)V(待测)可知,测定c(NaOH)偏大,故C错误;
D、读取盐酸体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=c(标准)×V(标准)V(待测)可知,测定c(NaOH)偏低,故D正确;
故答案为:D;
(2)酸式滴定管中的液面如图所示,起始读数为0.00mL,终点读数为26.10mL,
故答案为:0.00;26.10;
(3)根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸)=26.11+26.092mL=26.10mL,
根据反应方程式:HCl+NaOH=NaCl+H2O,n(HCl)=n(NaOH),即:0.0261L×0.1000mol/L=0.025L×c(NaOH),
解得c(NaOH)=0.0261L×0.1000mol/L0.025L=0.1044mol/L,
故答案为:0.1044mol/L.
本题解析:
本题难度:一般