微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 绿矾(FeSO4?7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:

已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是______.
(2)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是______;通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②______.
(3)操作IV的顺序依次为:______、结晶______.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②______.
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L?KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO-4+8H+═5Fe3++Mn2++4H2O).
①计算上述样品中FeSO4?7H2O的质量分数为______.
②若用上述方法测定的样品中FeSO4?7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有______;______.
2、计算题 现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x。将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO。
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):
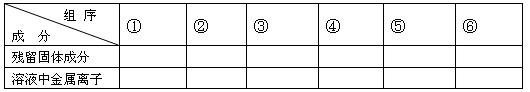
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为(用a、x表示)
(3)当x=0.5时,溶液中Fe3+和 Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a和b的值。
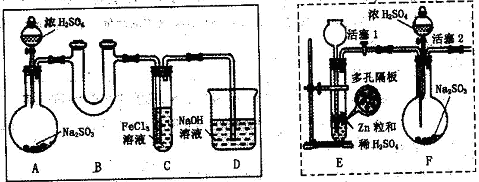
3、实验题 [2012·漳州质检](11分)某研究学习小组为探究Fe3+离子是否能氧化SO2,设计了如下的实验装置(假设实验中所用装置的气密性良好)。
 ?
?
(1)甲同学利用以上实线框内装置制取SO2并进行探究实验。
①装置A中发生反应的化学方程式为?。
②装置B的作用是?。
③反应一段时间后,甲同学取装置C中少量溶液,往其中加入HCl酸化的BaCl2溶液观察到有白色沉淀产生。由此他得出结论:Fe3+可氧化SO2。
(2)乙同学认为甲同学的实验不严谨,他用以上虚线框内装置替代装置A,先使装置E内试剂反应一段时间后,关闭活塞1,打开活塞2,又反应片刻后,取装置C中少量溶液,往其中加入酸性KMnO4溶液,观察到KMnO4溶液紫红色褪去。由此他得出结论:Fe3+已被SO2还原成Fe2+。
①该实验制H2时需用浓硫酸配制450mL3mol/L的稀硫酸,配制中所需的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需?。
配制过程中若其它操作无误,但没有洗涤烧杯与玻璃棒,则所配制溶液的浓度会??(填“偏高”、“偏低”或“无影响”)。
②在该实验过程中H2所起得作用是?。
(3)丙同学认为甲、乙的实验均不严谨,为此他沿用乙同学的实验装置及操作,重新实验。待装置F内反应一段时间后,取装置C中少量溶液,往其中加入HCl酸化的BaCl2溶液,得出与甲同学相同的结论。请你分析回答:
①甲同学实验不严谨的原因是?。(选填序号)
A.SO2溶解量太小
B.SO2不与Fe3+发生反应
C.H2SO3与BaCl2不反应
D.装置中的空气与SO2进入水中也可生成H2SO4