|
|
|
高中化学知识点归纳《水的电离平衡》考点巩固(2017年最新版)(三)
2017-08-01 02:09:57
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 25℃时,1L 0.01mol/LHCl溶液,水的离子积常数Kw为_______,溶液中H+的物质的量浓度为_______,水电离出的H+的物质的量浓度为_________,向上述溶液中加入1L 0.008mol/L的NaOH溶液,反应后溶液的pH为_________。
2、选择题 下列关于水的电离不正确的是
A.加酸或碱一定抑制水的电离
B.加盐一定促进水的电离
C.升高温度,水的pH值变小
D.常温下任何稀的酸、碱、盐水溶液中KW=10-14
|
3、选择题 下列几种微粒中能影响水的电离平衡,且能使水的电离平衡向右移动的是( )
A.HSO4-
B.Cl-
C.aX+?

D.bX2-

4、选择题 常温下c(H+)最小的是下列各项中的
A.pH=0的溶液.
B.0.04 mol·L-1 H2SO4
C.0.5 mol·L-1 HCl
D.0.05 mol·L-1HNO3
|
5、填空题 (15分)回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用。
(1)回收利用印刷电路板上的铜制备CuCl2。
实验室模拟回收过程如下:
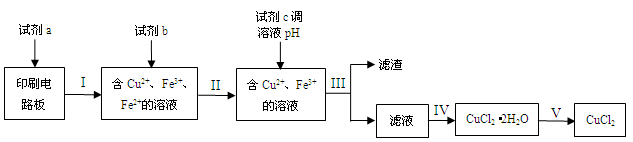
已知部分物质开始沉淀和沉淀完全时的pH如下表:
物质
| 开始沉淀
| 沉淀完全
|
Fe(OH)2
| 7.6
| 9.6
|
Fe(OH)3
| 2.7
| 3.7
|
Cu(OH)2
| 4.4
| 8.0
|
请回答下列问题:
①步骤III的操作名称是
。
②下列试剂中,可以作为试剂a的是
。
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行?
(填“是”或“否”),理由是
。
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜。
已知:2H2O2(l)=2H2O (l) +O2(g) △H1=-196kJ/mol
H2O(l)=H2(g) +1/2O2(g) △H2=+286kJ/mol
Cu(s) +H2SO4(aq)=CuSO4(aq) +H2(g) △H3=+64kJ/mol
则Cu(s) +H2O2(l) +H2SO4(aq) =CuSO4(aq) +2H2O(l) △H =
。
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是
。
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5 mol/L的硝酸溶液的体积是
L。
