微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,Ag2CrO4为砖红色沉淀。
(1) AgCl、AgI、 Ag2CrO4三种饱和溶液中,Ag+浓度由大到小顺序是 。现将等体积2.0×10—4 mol·L-1的AgNO3溶液和一定浓度的Na2CrO4溶液混合,若要产生Ag2CrO4沉淀,则Na2CrO4溶液至少浓度为 mol·L-1。
(2) 在室温下,向0.02mol·L-1的Na2CrO4溶液中滴加0.01mol·L-1稀硫酸,溶液由黄色转变为橙红色的Na2Cr2O7,该平衡转化的离子方程式为 。Na2Cr2O7可用来鉴别NaCl和NaNO2,鉴别时发生的离子方程式为 。
(3) 工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的pH值不断升高,溶液由酸性转变为碱性。在以上处理过程中,写出其阳极电极反应式: ,Cr2O72-转化为毒性较低的Cr3+的离子方程式为: 。
(4) 用AgNO3溶液滴定含Cl-的溶液,可测定溶液中的c(Cl-)。可滴入几滴 溶液为指示剂,滴定的终点现象为 。
参考答案:(14分)
(1)Ag2CrO4>AgCl>AgI 4.0×10—4 (各2分)
(2)2 CrO42-+2 H+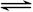 Cr2O72-+ H2O Cr2O72-+3NO2-+8H+="3" NO3-+2 Cr3++4H2O (各2分)
Cr2O72-+ H2O Cr2O72-+3NO2-+8H+="3" NO3-+2 Cr3++4H2O (各2分)
(3)Fe-2e-=Fe2+ Cr2O72-+6 Fe2++14H+="6" Fe3++2 Cr3++7 H2O(各2分)
(4) Na2Cr2O7 (或K2Cr2O7或含Cr2O72-) 加入最后一滴AgNO3溶液出现砖红色沉淀(各1分)
本题解析:
(1)根据Ksp进行计算,可以得到Ag+浓度大小关系,混合后c(Ag+)=1×10-4mol/L,Ksp=c2(Ag+)c(CrO42-),从而求出c(CrO42-)=2.0×10-4mol/L,故Na2CrO4浓度为4.0×10- 4mol/L。
(2)黄色转化为橙色,是铬酸根转化为重铬酸根,用重铬酸钠来鉴别,是应为NaNO2具有较强的还原性,可以与重铬酸根发生氧化还原反应,根据氧化还原反应基本原理可以写出化学方程式。
(3)阳极发生氧化反应,因为使用铁做电解,为活性电极,优先放电,故Fe-2e-=Fe2+;二价铁具有还原性,可将重铬酸根还原,生成三价铬,然后转化为氢氧化铬沉淀。
(4)根据上面数据可以看出,氯离子先与铬酸根与银离子产生沉淀,故可以用重铬酸根或铬酸根,氯离子沉淀完全,生成砖红色沉淀。
考点:考查沉淀溶解平衡、电解以及滴定等知识。
本题难度:困难
2、选择题 下列说法正确的是
[? ]
A.胶体与其他分散系的本质区别是能否发生丁达尔现象
B.一定温度下,任何酸、碱、盐的水溶液中,c(H+)·c(OH-)均为一定值
C.在可逆反应中,改变一个影响化学平衡的条件,其正、逆反应速率必然同时改变
D.船底镶嵌锌块,锌失电子,保护船体免受腐蚀
参考答案:D
本题解析:
本题难度:一般
3、选择题 常温下,某溶液中由水电离的c(H+)=1×10-13mol·L-1,该溶液可能是
[? ]
①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④
B.①②
C.②③
D.③④
参考答案:A
本题解析:
本题难度:一般
4、选择题 室温下,甲溶液中水电离出的H+浓度为10-12 mol·L-1,乙溶液中水电离出的H+浓度为10-2 mol·L-1,下列说法正确的是
? [? ]
A.甲乙两溶液的pH不可能相同
B.甲乙两种溶液中加入Al粉都一定会产生H2
C.HCO3-不可能在甲、乙两溶液中大量共存
D.甲不可能是盐溶液,乙不可能是酸或碱溶液
参考答案:C
本题解析:
本题难度:一般
5、填空题 写出下列物质在水溶液中的电离方程式:
NaHSO4 ____________,
K2SO4 _____________,
NH4NO3 _____________。
参考答案:“略”
本题解析:
本题难度:一般