| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《水的电离平衡》考点巩固(2017年最新版)(四)
参考答案:B 本题解析:H2O 本题难度:一般 3、选择题 下列几种微粒中能影响水的电离平衡,且能使水的电离平衡向右移动的是( ) 参考答案:D 本题解析: 本题难度:简单 4、选择题 常温下c(H+)最小的是下列各项中的 |
参考答案:D
本题解析:A、氢离子浓度为1mol/L;B、氢离子浓度为0.08 mol/L;C、氢离子浓度为0.5 mol/L;D、氢离子浓度为0.05 mol/L。所以最小的为D。
考点:离子浓度的比较。
本题难度:一般
5、填空题 (15分)回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用。
(1)回收利用印刷电路板上的铜制备CuCl2。
实验室模拟回收过程如下: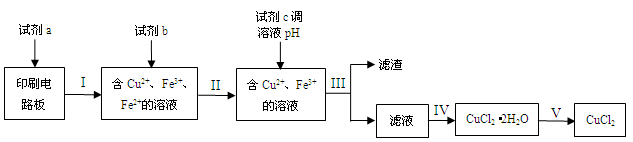
已知部分物质开始沉淀和沉淀完全时的pH如下表:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 4.4 | 8.0 |
参考答案:(1)①过滤(2分)②C(2分)③否(1分);不能除去亚铁离子,影响所得氯化铜纯度(2分)(2)-320KJ/mol(3分)(3)H2O2+2H++2e-=2H2O(2分)(4)4(3分)
本题解析:(1)①操作是将固体和液体分开,用过滤。②利用印刷电路板上的铜制备CuCl2,反应后的溶液中有铁元素,说明使用的是氯化铁,选C。③需要将溶液中的铁元素变成沉淀,若以氢氧化亚铁的沉淀形式,溶液的pH在7.6到9.6之间,而铜离子已经沉淀,不能分离,若以氢氧化铁的形式沉淀,pH2.7开始沉淀,到3.7沉淀完全,这时铜离子没有开始沉淀,所以要将亚铁氧化成铁离子才能调节溶液的pH值进行沉淀,所以不可行,选否;因为那样不能除去亚铁离子,会影响所得氯化铜纯度。(2)根据盖斯定律,将方程式进行四则运算,③+②/2-②,则反应热=+64-196/2-286=-320KJ/mol。(3)原电池中铜做负极,过氧化氢在正极反应得到电子,电极反应为:H2O2+2H++2e-=2H2O。(4)根据离子方程式分析:3Cu+8H++2NO3-=3Cu2++2NO+4H2O,生成3摩尔硫酸铜,需要3摩尔铜,2摩尔硝酸,所以硝酸的体积为2/0.5=4升。
考点:原电池的电极反应的书写,物质的分离,盖斯定律
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《生活中的有.. | |