微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用蒸馏水稀释0.1mol/L的醋酸至0.01mol/L,稀释过程中温度不变,下列各项中始终保持增大趋势的是( )
A.
B.c(H+)?c(CH3COO-)
c(CH3COOH)
|
C.c(CH3COOH)
D.c(H+)
参考答案:A.加水稀释醋酸,促进醋酸电离,n(H+)增大,n(CH3COOH)减小,所以C(H+)C(CH3COOH)增大,故A正确;
B.温度不变,醋酸的电离平衡常数不变,故B错误;
C.加水稀释醋酸,促进醋酸电离,n(CH3COOH)减小,V(溶液)增大,所以c(CH3COOH)减小,故C错误;
D.醋酸是弱电解质,加水稀释醋酸,促进醋酸电离,则n(H+)增大,但n(H+)增大的程度小于V(溶液)增大的程度,所以c(H+) 减小,故D错误;
故选A.
本题解析:
本题难度:一般
2、填空题 (8分)已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为
醋酸 K=1.75×10-5 次氯酸 K=2.95×10-8
碳酸K1=4.30×10-7 K2=5.61×10-11 亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式K1=__________。
(2)在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是________。等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为 。
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是________。
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数
(4)下列离子方程式中错误的是________。
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO3—+HClO
b.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.过量CO2通入澄清石灰水中:CO2+OH-=== HCO3—
参考答案:
(1)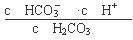 (2)Na2CO3;c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+)
(2)Na2CO3;c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+)
(3)a (4)b
本题解析:(1)根据电离平衡常数的含义可得碳酸的第一级电离平衡常数表达式K1=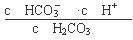 ;(2)酸的电离平衡常数越小,则相应的酸根离子结合H+的能力就越强,由于在相同温度下电离平衡常数最小的碳酸的二级电离K2=5.61×10-11,所以在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是Na2CO3;等浓度的Na2CO3和NaHCO3的混合溶液,由于HCO3—、CO32—都会发生水解反应,而且水解程度HCO3—< CO32—,水解是溶液显碱性,c(OH-)>c(H+);但是盐水解的程度是微弱的,主要还是以盐电离产生的离子存在,所以根据物料守恒可得c(Na+)>c(HCO3—)>c(CO32—)。故溶液中各离子浓度大小顺序为c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+);(3)若保持温度不变,在醋酸溶液中通入少量HCl,a.CH3COO-会结合形成CH3COOH,所以c(CH3COO-)变小,正确;b.由于加入了H+,所以c(H+)会增大;错误;c.醋酸的电离平衡常数只与温度有关,温度不变,所以电离平衡常数就不变,错误;(4)由于酸性H2CO3>HClO> HCO3—,所以少量CO2通入次氯酸钠溶液中,会发生反应:CO2+H2O+ClO-=== HCO3—+HClO,正确;b.由于HClO有强氧化性,而H2SO3有还原性,所以少量SO2通入次氯酸钙溶液中,会发生氧化还原反应:Ca2++ClO-+SO2+H2O===CaSO4↓+2H++Cl-,错误;c.过量CO2通入澄清石灰水中,发生反应得到可溶性酸式盐,离子方程式是:CO2+OH-=== HCO3—,正确。
;(2)酸的电离平衡常数越小,则相应的酸根离子结合H+的能力就越强,由于在相同温度下电离平衡常数最小的碳酸的二级电离K2=5.61×10-11,所以在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是Na2CO3;等浓度的Na2CO3和NaHCO3的混合溶液,由于HCO3—、CO32—都会发生水解反应,而且水解程度HCO3—< CO32—,水解是溶液显碱性,c(OH-)>c(H+);但是盐水解的程度是微弱的,主要还是以盐电离产生的离子存在,所以根据物料守恒可得c(Na+)>c(HCO3—)>c(CO32—)。故溶液中各离子浓度大小顺序为c(Na+)>c(HCO3—)>c(CO32—)>c(OH-)>c(H+);(3)若保持温度不变,在醋酸溶液中通入少量HCl,a.CH3COO-会结合形成CH3COOH,所以c(CH3COO-)变小,正确;b.由于加入了H+,所以c(H+)会增大;错误;c.醋酸的电离平衡常数只与温度有关,温度不变,所以电离平衡常数就不变,错误;(4)由于酸性H2CO3>HClO> HCO3—,所以少量CO2通入次氯酸钠溶液中,会发生反应:CO2+H2O+ClO-=== HCO3—+HClO,正确;b.由于HClO有强氧化性,而H2SO3有还原性,所以少量SO2通入次氯酸钙溶液中,会发生氧化还原反应:Ca2++ClO-+SO2+H2O===CaSO4↓+2H++Cl-,错误;c.过量CO2通入澄清石灰水中,发生反应得到可溶性酸式盐,离子方程式是:CO2+OH-=== HCO3—,正确。
考点:考查弱电解质的电离平衡常数的应用、盐的水解、离子浓度大小比较、离子方程式的正误判断的知识。
本题难度:一般
3、选择题 在室温下,下列叙述正确的是( )
A.将1mL1.0×10-5mol/L盐酸稀释到1000mL,得到pH=8的盐酸
B.将1mLpH=3的一元酸溶液稀释到10mL,若溶液的pH<4,则此酸为弱酸
C.用pH=1的盐酸分别中和1mLpH=13NaOH溶液和氨水,NaOH消耗盐酸的体积大
D.pH=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO42-)
参考答案:A、因1.0×10-5mol/L的盐酸溶液其PH=5,稀释1000倍时PH不会大于7,故A错误;
B、若为pH=3的一元强酸稀释10倍PH应为4,而弱酸在稀释时变化小,则若溶液的pH<4,此酸为弱酸,故B正确;
C、因pH=13NaOH溶液和氨水,氨水为弱碱溶液,则氨水的浓度大,等体积等PH值的两种碱中氨水中溶质的物质的量大,则消耗的盐酸多,故C错误;
D、pH=2的盐酸中c(Cl-)=0.01mol/L,而pH=1的硫酸溶液中,硫酸为二元酸,则c(SO42-)=0.05mol/L,故D错误;
故选:B.
本题解析:
本题难度:简单
4、选择题 下列图示与对应的叙述相符的是

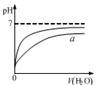
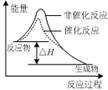

图甲 图乙 图丙 图丁
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B.图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C.图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D.图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
参考答案:B
本题解析:A、图像中交叉点左边是未平衡时曲线,右边是平衡曲线,温度高,正反应速率小于逆反应速率,平衡逆向移动,反应放热,错误;B、醋酸是弱酸,稀释时电离程度增大,pH变化小,正确;C、催化剂只改变反应速率,不改变焓变,错误;D、逐滴加盐酸,首先生成碳酸氢钠然后才产生二氧化碳气体,错误。
考点:考查化学图像与原理有关问题。
本题难度:一般
5、选择题 下列电离方程式错误的是
A.Na2CO3=2Na++CO32-
B.NaOH=Na++O2—+H+
C.H2SO4=2H++SO42-
D.KHCO3=K++HCO3-
参考答案:B
本题解析:略
本题难度:简单