微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)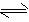 Z(g)+W(s);△H<0下列叙述正确的是
Z(g)+W(s);△H<0下列叙述正确的是
[? ]
A.增加少量W,正反应速率减小
B.当容器中气体的密度不变时,反应达到平衡
C.降低温度,平衡不移动
D.平衡后加入Z ,上述反应的△H减小
2、选择题 在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是?
[? ]
A、反应混合物的浓度?
B、反应体系的压强?
C、正、逆反应的速率?
D、反应物的转化率
3、选择题 在恒容的各个密闭容器中,下列反应分别达到平衡后,有关说法正确的是
[? ]
A.2HI(g) H2(g)+I2(g);△H>0,若降低温度,颜色加深,压强增大
H2(g)+I2(g);△H>0,若降低温度,颜色加深,压强增大
B.2NO2(g) N2O4(g);△H<0,充入氩气,压强增大,红棕色变浅
N2O4(g);△H<0,充入氩气,压强增大,红棕色变浅
C.2SO2(g)+O2(g)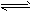 2SO3(g);△H<0,升温后,气体密度不变,平均相对分子质量减小
2SO3(g);△H<0,升温后,气体密度不变,平均相对分子质量减小
D.3Fe(s)+4H2O(g)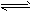 Fe3O4(s)+4H2(g);△H<0,加入铁后,Fe3O4将增加
Fe3O4(s)+4H2(g);△H<0,加入铁后,Fe3O4将增加
4、填空题 (本题共12分)对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:
2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=
N2(g)+2CO2(g) ΔH=  Q(Q>0)。
Q(Q>0)。
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间/s
| 0
| 1
| 2
| 3
| 4
| 5
|
c(NO)/mol·L-1
| 1.00×10-3
| 4.50×10-4
| 2.50×10-4
| 1.50×10-4
| 1.00×10-4
| 1.00×10-4
|
c(CO)/mol·L-1
| 3.60×10-3
| 3.05×10-3
| 2.85×10-3
| 2.75×10-3
| 2.70×10-3
| 2.70×10-3
|
29.写出该反应的平衡常数表达式__________________________________________。
30.前2s内的平均反应速率υ(N2) = mol/(L·s);达到平衡时,CO的转化率为 。
31.下列描述中能说明上述反应已达平衡的是________________
A.2υ正(NO)=υ逆(N2)
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的转化率不再发生变化
32.采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,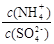 的值将 (填“变大”、“不变”或“变小”)
的值将 (填“变大”、“不变”或“变小”)
33.有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是________________(填编号);
34.向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀。用电离平衡原理解释上述现象__________________________________________________________。
5、计算题 I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s) + 3CO(g) 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
(1)已知:①Fe2O3(s) + 3C(石墨)="2Fe(s)" + 3CO(g) △H1
②C(石墨)+ CO2(g) = 2CO(g) △H2
则△H___________________(用含△H1 、△H2的代数式表示)。
(2)高炉炼铁反应的平衡常数表达式K=____________________________。
(3)在某温度时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3
| CO
| Fe
| CO2
|
甲/mol
| 1.0
| 1.0
| 1.0
| 1.0
|
乙/mol
| 1.0
| 1.5
| 1.0
| 1.0
|
①甲容器中CO的平衡转化率为_______________________。
②下列说法正确的是____________________(填编号)。
A.若容器压强恒定,反应达到平衡状态
B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的
D.增加Fe2O3就能提高CO的转化率
II.纳米MgO可用尿素与氯化镁合成。某小组研究该反应在温度为378~398K时的反应时间、反应物配比等因素对其产率的影响。请完成以下实验设计表:
编号
| 温度/K
| 反应时间/h
| 反应物物质的量配比
| 实验目的
|
①
| 378
| 4
| 3∶1
| 实验②和④探究________
______________________
实验②和__________探究
反应时间对产率的影响。
|
②
| 378
| 4
| 4∶1
|
③
| 378
| 3
| _______
|
④
| 398
| 4
| 4∶1
|
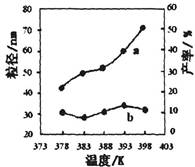
下图为温度对纳米MgO产率(曲线a)和粒径(曲线b)的影响,请归纳出温度对纳米MgO制备的影响规律(写出一条):
___________________________________________。