微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)

CH3CH2OH(g)+3H2O(g)?下列叙述错误的是( )
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
参考答案:A、因催化剂能提高化学反应速率,加快反应进行,则在一定时间内提高了生产效率,故A对;
B、反应需在300℃进行是为了获得较快的反应速率,不能说明反应是吸热还是放热,故B错;
C、充入大量CO2气体,能使平衡正向移动,提高H2的转化率,故C对;
D、从平衡混合物中及时分离出产物,使平衡正向移动,可提高CO2和H2的转化率,故D对;
故选:B.
本题解析:
本题难度:一般
2、实验题 H2O2是实验室常用的一种化学试剂。某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号
| 反应物
| 催化剂
|
①
| 10mL2% H2O2溶液
| 无
|
②
| 10mL5% H2O2溶液
| 无
|
③
| 10mL5% H2O2溶液
| 1mL0.1mol·L-1FeCl3溶液
|
④
| 10mL5% H2O2溶液+少量HCl溶液
| 1mL0.1mol·L-1FeCl3溶液
|
⑤
| 10mL5% H2O2溶液+少量NaOH溶液
| 1mL0.1mol·L-1FeCl3溶液
|
(1)实验①和②的目的是_ ,
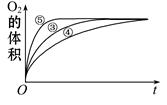
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。分析下图能够得出的结论是 。
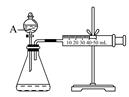
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如下图所示的实验装置进行实验。
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是 。
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为 ;
参考答案:(8分)(1)探究H2O2溶液的浓度的变化对分解速率的影响。
(2)图像显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱。
(3)测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率。
(4)Fe2++2H2O2+4H+= Fe3++4H2O
本题解析:(1)根据表中数据可知,实验①②中不同之处在于双氧水的浓度不同,所以实验目的是探究H2O2溶液的浓度的变化对分解速率的影响。
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,即实验结论是图像显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱。
(3)要比较Fe3+和Cu2+对H2O2分解的催化效果,应在相同的条件下利用一个变量来比较,同时还需要测量测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率。
(4)双氧水具有氧化性,能把亚铁离子氧化生成铁离子,反应的离子方程式是Fe2++2H2O2+4H+=Fe3++4H2O。
考点:考查影响化学反应速率因素的实验探究
点点评:该题是中等难度的试题,试题综合性强,侧重对学生实验探究能力的培养,有利于激发学生的学习积极性,也有助于培养学生的规范实验设计能力。所以该类试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该题能较好的考查学生实验设计、数据处理、图象分析的综合能力。在解答时注意已知信息的利用。
本题难度:困难
3、选择题 下列说法正确的是( )
A.其它条件相同时,增大反应物浓度使分子获得能量,活化分子百分数提高,反应速率增大
B.判断过程的自发性能确定过程能否发生和过程发生的速率
C.体系有自发地向混乱度增加(即熵增)的方向转变的倾向,这是自然界的普遍规律
D.催化剂不影响反应活化能,从而只影响反应速率,不影响化学平衡
参考答案:A.其它条件相同时,增大浓度,活化分子数目增多,百分数没有变化,反应速率加快,故A错误;
B.过程的自发性与反应速率无关,可确定过程能否发生,故B错误;
C.由普遍规律可知,熵增的反应可自发进行,所以体系有自发地向混乱度增加(即熵增)的方向转变的倾向,故C正确;
D.催化剂降低反应所需的活化能,只影响反应速率,不影响化学平衡,故D错误;
故选C.
本题解析:
本题难度:一般
4、选择题 升高温度时,化学反应速率加快,主要原因是(? )
A.分子运动速率加快,使该反应物分子的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.该化学反应的过程是吸热的
D.该化学反应的过程是放热的
参考答案:B
本题解析:A.分子运动速率加快,使该反应物分子的碰撞机会增多,但是不是所有的分子间的碰撞都能发生化学反应。只有那些分子能量高的按照一定去向发生的碰撞才能发生化学反应。错误。B.升高温度时,反应物分子的能量增加,活化分子数增多,由于分子总数没有变化,所有活化分子百分数增大,有效碰撞次数增多。因此化学反应速率加快。正确。无论是放热反应还是吸热反应,当升高温度时,反应物分子的能量都增加,使一部分分子变为活化分子,活化分子百分数增大,有效碰撞次数增多,反应速率加快。C.D都是错误的。
本题难度:一般
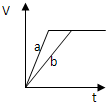
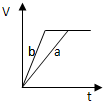
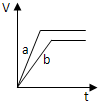
5、选择题 等质量的两份锌粉a和b,分别加入过量的稀硫酸中,并向a中加入少量氧化铜,下图表示产生H2的体积(V)与时间(t)的关系正确的是( )
A.
B.
C.
D.
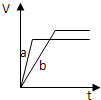
参考答案:锌和硫酸反应,加入硫酸铜溶液后,锌和铜离子反应置换出金属铜,形成锌、铜、稀硫酸原电池,加速金属锌和硫酸反应的速率,所以反应速率是:a>b,
速率越大,锌完全反应时所用的时间越短,所a所用的时间小于b的时间;
产生氢气的量取决于金属锌的质量,而a中,金属锌一部分用于置换金属铜,所以和硫酸反应生成氢气的量减少,所以氢气的体积是:a<b.
故选D
本题解析:
本题难度:一般