|
高中化学知识点大全《盐类水解的原理》考点强化练习(2017年押题版)(四)
2017-08-06 09:16:52
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数最多的是:( )
A.KCl
B.Mg(OH)2
C.Na2CO3
D.MgSO4
|
参考答案:C
本题解析:氢氧化镁难溶于水,阴离子数量最少。由于碳酸钠溶于水发生水解反应,方程式为CO32-+H2O HCO3-+OH-,根据方程式可知,消耗1mol阴离子,产生2mol阴离子,所以C中最多。答案选C。 HCO3-+OH-,根据方程式可知,消耗1mol阴离子,产生2mol阴离子,所以C中最多。答案选C。
考点:盐类的水解
点评:本题主要考查盐类水解的应用,但需要注意的就是如果固体难溶,则其离子在水溶液中一定最少。
本题难度:简单
2、填空题 (14分)某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。
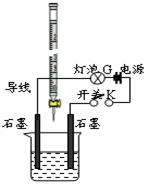
(1)实验时,烧杯中应盛 (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 。烧杯中得到的溶液pH= 。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“⑵”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为_ _。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是_ _____(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
参考答案:⑴ B
⑵ 5 反应后烧杯中自由离子的浓度约为原溶液的一半 6.5
⑶ A为多元强酸(答案合理就可给分)
⑷ M++H2O  MOH+H+ ④⑤ MOH+H+ ④⑤
本题解析:⑴图中为酸式滴定管,所以烧杯中应盛碱溶液B;⑵当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,恰好完全反应,生成一元强酸强碱盐,离子数目与原B溶液中相等,体积约为原来2倍,离子的浓度约为原溶液的一半,导电能力约为原来1/2,溶液为中性pH=6.5。(3)溶液为中性时,溶液中阳离子浓度大于阴离子浓度,可能A为多元强酸;⑷a+b=13说明酸中c(H+)与碱中c(OH-)相等,二者混合后溶液呈碱性,说明碱为弱碱,所以碱过量,弱碱阳离子M+水解,水解反应的离子方程式为M++H2O  MOH+H+;由于溶液呈碱性,c(OH-)>c(H+),①、③错误,根据c(OH-)>c(H+)和电荷守恒c(M+)+c(H+)=c(R-)+c(OH-)可得c(M+)>c(R-),因为OH-和H+均来自于弱电解质的电离,其浓度应该很小,故c(M+)>c(R-)>c(OH-)>c(H+),所以④正确,根据电荷守恒是关系,⑤正确,若HR是强酸,此时溶液中不再有HR分子,②是错误的,由于(3)的混合溶液中MOH有大量剩余,即c(MOH)>0,若⑥正确,则c(H+)>c(OH-),溶液显酸性,所以⑥错误。 MOH+H+;由于溶液呈碱性,c(OH-)>c(H+),①、③错误,根据c(OH-)>c(H+)和电荷守恒c(M+)+c(H+)=c(R-)+c(OH-)可得c(M+)>c(R-),因为OH-和H+均来自于弱电解质的电离,其浓度应该很小,故c(M+)>c(R-)>c(OH-)>c(H+),所以④正确,根据电荷守恒是关系,⑤正确,若HR是强酸,此时溶液中不再有HR分子,②是错误的,由于(3)的混合溶液中MOH有大量剩余,即c(MOH)>0,若⑥正确,则c(H+)>c(OH-),溶液显酸性,所以⑥错误。
考点:弱电解质在水溶液中的电离平衡、pH的简单计算、离子浓度大小比较。
本题难度:困难
3、填空题 (10分)(1)常温下,向20 mL 0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:

①当V(NaOH)=20mL时,溶液中离子浓度的大小关系: ___________________;
②等体积、等物质的量浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水_________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入___________。
(2)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。 N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是__________(填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:如果将反应温度提高到T2,Ru催化分解初始浓度为c0的氨气过程中α(NH3)—t的总趋势曲线(标注Ru—T2)
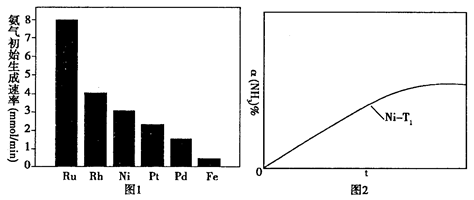
③假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K=_____________。
参考答案:(10分)(1)①C(Na+)>C(HA-)>C(H+)>C(A2-)>C(OH-) (2分)②小;(1分)碱(其他合理答案均可)(2分)(2)① Fe (1分) ②见图曲线 Ru-T2  (2分) (2分)
③ 0.12c02(2分)
本题解析:(10分)(1)①当氢氧化钠的体积为20毫升时,反应只生成NaHA,根据图像,溶液显酸性,电离大于水解,所以离子浓度关系为C(Na+)>C(HA-)>C(H+)>C(A2-)>C(OH-);②当二者等浓度等体积混合时,溶质为NaHA,溶液显酸性,电离大于水解,所以抑制水的电离,水的电离程度比纯水的小;要使溶液显中性,需要加入碱或碱性物质。(2)①氨气分解反应的活化能最大的说明反应速率最慢,从图分析,使用Fe做催化剂时反应最慢。②如果将反应温度提高到T2,Ru催化分解,反应速率加快,先达到平衡,氨气的由于温度升高,促进分解,氨气的分解转化增大,所以曲线为:

③氨气分解的平衡转化率为40%,则分解的氨气的浓度为c0*40%,生成氮气的浓度为c0*40%/2,氢气的浓度为c0*40%*3/2,则平衡常数为(c0×40%/2)(c0×40%×3/2)3/c0-c0×40%)2=0.12c02。
考点:酸碱混合后溶液酸碱性的判断,催化剂对反应速率和平衡的影响,化学平衡常数的计算
本题难度:困难
4、选择题 为探究某种盐的水解是吸热反应。有四位同学分别设计了如下实验方案:
同学
| 实验设计
| 甲
| 将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
| 乙
| 加热能使溶液中的Fe3+转化成Fe(OH)3沉淀,说明Fe3+水解是吸热的
| 丙
| 通过实验发现同浓度的热的纯碱溶液比冷的纯碱溶液去油污效果好,说明碳酸钠水解是吸热的
| 丁
| 在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的
|
其中不正确的是( )
A.甲 B.乙 C.丙 D.丁
参考答案:A
本题解析:硝酸铵晶体溶于水存在溶解和水解两个过程,所以无法判断水温下降是溶解所致还是水解所致,A错。
本题难度:一般
5、选择题 下列各反应的化学方程式中,属于水解反应的是
A.HCO3— + H2O CO32—+ H3O+ CO32—+ H3O+
B.H2O + H2O OH— + H3O+ OH— + H3O+
C.CO2 + H2O H2CO3 H2CO3
D.CO32— +H2O HCO3— + OH— HCO3— + OH—
|  CO32—+ H3O+ 属于电离过程,不选;B. H2O + H2O
CO32—+ H3O+ 属于电离过程,不选;B. H2O + H2O OH— + H3O+属于电离过程,不选;C.CO2 + H2O
OH— + H3O+属于电离过程,不选;C.CO2 + H2O H2CO3 属于可逆反应,不选;D.CO32— +H2O
H2CO3 属于可逆反应,不选;D.CO32— +H2O HCO3— + OH—属于水解反应,选D。
HCO3— + OH—属于水解反应,选D。