|
|
|
高中化学知识点大全《盐类水解的原理》考点强化练习(2017年押题版)(六)
2017-08-06 09:16:52
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是

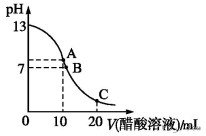
A.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.在B点:c(OH-)=c(H+),c(Na+)= c(CH3COO-))
C.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.在C点: c(CH3COO-)+c(CH3COOH)=2c(Na+)
|
参考答案:C
本题解析:
A、在C点,CH3COOH过量,以CH3COOH电离为主,溶液呈酸性,c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A项正确;
B、B点时溶液pH等于7,为中性,c(OH-)=c(H+),由电荷守恒得c(CH3COO-)=c(Na+),故B项正确;
C、在A点是20mL0.1mol·L-1NaOH溶液和10mL0.2mol·L-1醋酸溶液恰好反应完全,生成的醋酸钠中的醋酸根离子水解使溶液呈碱性,离子浓度的关系应为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C项不正确;
D、在C点,由物料守恒可得c(CH3COO-)+c(CH3COOH)=2c(Na+),故D项正确。
考点:考查盐类的水解、离子浓度大小比较
点评:题考查了盐类的水解、离子浓度大小比较,难度中等。解题的关键是掌握好酸碱的反应时量的关系,并根据酸碱的量来分析溶液中离子浓度的大小。
本题难度:困难
2、填空题 (8分)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_______ __ ___。
(2)若溶液M由10 mL 2 mol·L-1 NaHA溶液与2 mol·L-1 NaOH溶液等体积混合而得,
则溶液M的pH_ __7(填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为_ _ __。
(3)若溶液M有下列三种情况:
①0.01 mol·L-1的H2A溶液
②0.01 mol·L-1的NaHA溶液
③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,
则三种情况的溶液中H2A分子浓度最大的为______;pH由大到小的顺序为______。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为________(填“大于、等于、小于”或“均有可能”)。
参考答案:(8分)
(1)H2A H++HA- ,HA- H++HA- ,HA- H++A2-(2分) H++A2-(2分)
(2)>(1分),c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) (2分)
(3)③(1分), ②>③>① (1分),
(4)均有可能(1分)
本题解析:(1)因为该溶液中存在H2A分子、HA-、A2-,说明该酸是弱酸,所以电离方程式为H2A H++HA- ,HA- H++HA- ,HA- H++A2-; H++A2-;
(2)10 mL 2 mol·L-1 NaHA溶液与2 mol·L-1 NaOH溶液等体积混合,生成Na2A,因为A2-的水解会使溶液呈碱性,A2-+H2O HA-+OH-,所以混合后的溶液pH>7,溶液存在的离子是Na+、HA-、A2-、H+、OH-,不水解的离子大于水解离子的浓度,所以离子浓度的大小关系是c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+); HA-+OH-,所以混合后的溶液pH>7,溶液存在的离子是Na+、HA-、A2-、H+、OH-,不水解的离子大于水解离子的浓度,所以离子浓度的大小关系是c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+);
(3)①②相比,②中的HA-水解才得到H2A,所以①中的H2A浓度大;③混合后的溶液是0.01 mol·L-1的H2A与0.01 mol·L-1的NaHA溶液的混合液,因为NaHA的存在,使H2A的电离受到抑制,所以③中H2A的浓度大于①,则③的溶液中H2A分子浓度最大;①③溶液呈酸性,且③中的H2A的电离受到抑制,所以①溶液的酸性强,pH小;②的溶液呈碱性,所以三种溶液的pH由大到小的顺序是②>③>①;
(4)混合溶液c(H+)/c(OH-)=104,则c(H+)=10-5mol/L,说明混合后的溶液呈酸性,因为H2A为弱酸,pH=3H2A溶液与pH=11的NaOH溶液相比,氢离子浓度与氢氧根离子浓度相等,则酸的浓度大于碱的浓度,等体积或酸的体积大或者酸的体积小,但酸的物质的量多时,混合后的溶液都会呈酸性,所以不能确定V1与V2的大小关系。
考点:考查酸碱混合的计算,溶液中离子浓度的比较,溶液pH的判断
本题难度:困难
3、选择题 某酸的酸式盐NaHY的水溶液中,HY-的电离程度小于HY-的水解程度,有关叙述中正确的是( )
A.H2Y在电离时为:H2Y+H2O 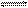 HY-+H3O+ HY-+H3O+
B.在该盐的溶液中,离子浓度为:
c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.在该盐的溶液中,离子浓度为:
c(Na+)>c(HY-)>c(Y2-)>c(OH-)>c(H+)
D.HY-的水解方程式为:HY-+H2O 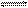 H3O++Y2- H3O++Y2-
|
参考答案:A
本题解析:略
本题难度:一般
4、选择题 在蒸发皿中加热蒸干下列物质的溶液,再灼烧可以得到原溶质固体的是
A.AlCl3
B.NaHCO3
C.MgSO4
D.KMnO4
参考答案:C
本题解析:A、AlCl3+3H2O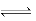 Al(OH)3+3HCl,加热蒸干,HCl易挥发,平衡右移,生成氢氧化铝,再灼烧2Al(OH)3
Al(OH)3+3HCl,加热蒸干,HCl易挥发,平衡右移,生成氢氧化铝,再灼烧2Al(OH)3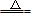 Al2O3+3H2O,最终生成氧化铝,不符合题意;B、加热蒸干溶液,得到碳酸氢钠固体,再灼烧2NaHCO3
Al2O3+3H2O,最终生成氧化铝,不符合题意;B、加热蒸干溶液,得到碳酸氢钠固体,再灼烧2NaHCO3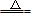 Na2CO3+H2O+CO2↑,最终得到碳酸钠,不符合题意;C、硫酸镁溶液加热蒸干,得到硫酸镁固体,硫酸镁性质稳定,受热不分解,符合题意;D、高锰酸钾溶液加热蒸干,得到高锰酸钾固体,高锰酸钾不稳定受热分解2KMnO4
Na2CO3+H2O+CO2↑,最终得到碳酸钠,不符合题意;C、硫酸镁溶液加热蒸干,得到硫酸镁固体,硫酸镁性质稳定,受热不分解,符合题意;D、高锰酸钾溶液加热蒸干,得到高锰酸钾固体,高锰酸钾不稳定受热分解2KMnO4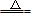 K2MnO4+MnO2+O2↑,不符合题意。
K2MnO4+MnO2+O2↑,不符合题意。
考点:考查盐类水解、元素及其化合物的性质。
本题难度:一般
5、选择题 下列依据相关实验得出的结论正确的是
A.将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3
B.将某气体通入品红溶液中,品红溶液褪色,则此气体一定是SO2
C.取少许某溶液,滴加数滴KSCN溶液,无明显现象;再另取少许原溶液,先滴少量新制氯水,再滴加数滴KSCN溶液,溶液变血红色,则原溶液中一定含Fe2+
D.在淀粉溶液中加入稀硫酸并加热片刻后,再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解
参考答案:C
本题解析:A、硫酸铝溶液中铝离子水解生成氢氧化铝和硫酸,硫酸是高沸点酸,所以即使加热,铝离子的水解不会彻底反应,所以最终得到的固体仍是硫酸铝,错误;B、使品红溶液褪色的不一定是二氧化硫气体,如氯气、臭氧等都能使品红溶液褪色,错误;C、铁离子与KSCN溶液反应,溶液变红色,加入KSCN溶液后,溶液不变红色,说明不含铁离子,滴加少量氯水后溶液变红色,说明原溶液中存在亚铁离子,加入氯水后,氯气将亚铁离子氧化为铁离子,溶液变红色,正确;D、银镜反应的条件是在碱性条件下,淀粉水解时加入稀硫酸,水解后溶液呈酸性,所以未中和稀硫酸,直接加入银氨溶液,未出现银镜,不能说明淀粉未发生水解,错误,答案选C。
考点:考查对实验方案的评价
本题难度:一般
 Al(OH)3+3HCl,加热蒸干,HCl易挥发,平衡右移,生成氢氧化铝,再灼烧2Al(OH)3
Al(OH)3+3HCl,加热蒸干,HCl易挥发,平衡右移,生成氢氧化铝,再灼烧2Al(OH)3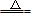 Al2O3+3H2O,最终生成氧化铝,不符合题意;B、加热蒸干溶液,得到碳酸氢钠固体,再灼烧2NaHCO3
Al2O3+3H2O,最终生成氧化铝,不符合题意;B、加热蒸干溶液,得到碳酸氢钠固体,再灼烧2NaHCO3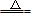 Na2CO3+H2O+CO2↑,最终得到碳酸钠,不符合题意;C、硫酸镁溶液加热蒸干,得到硫酸镁固体,硫酸镁性质稳定,受热不分解,符合题意;D、高锰酸钾溶液加热蒸干,得到高锰酸钾固体,高锰酸钾不稳定受热分解2KMnO4
Na2CO3+H2O+CO2↑,最终得到碳酸钠,不符合题意;C、硫酸镁溶液加热蒸干,得到硫酸镁固体,硫酸镁性质稳定,受热不分解,符合题意;D、高锰酸钾溶液加热蒸干,得到高锰酸钾固体,高锰酸钾不稳定受热分解2KMnO4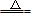 K2MnO4+MnO2+O2↑,不符合题意。
K2MnO4+MnO2+O2↑,不符合题意。