微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:
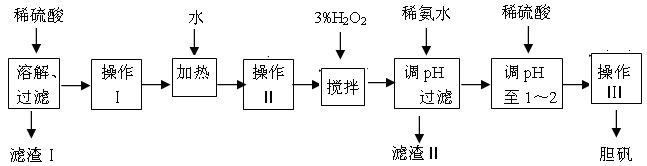
已知Fe3+、Fe2+ 、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
?
| Fe3+
| Fe2+
| Cu2+
|
开始沉淀时的pH
| 2.7
| 7.6
| 5.2
|
完全沉淀时的pH
| 3.7
| 9.6
| 6.4
|
?
(1)加入3% H2O2之前必须进行操作Ⅱ,操作Ⅱ的名称是?;
H2O2参加反应的离子方程式为?。
(2)加稀氨水调节pH的目的是?,pH应调至?范围。下列物质可用来替代稀氨水的是?。
①NaOH?②Fe2O3?③CuO?④Na2CO3
(3)经操作Ⅰ得到粗胆矾,操作Ⅲ得到精致胆矾。两步操作相同,具体包括?、?、
过滤、?、干燥等步骤。
参考答案:(12分,每空2分)(1)冷却(1分);? 2Fe2+ + H2O2 + 2H+= 2Fe3+ +2H2O(2分)
(2)使Fe3+完全转变成Fe(OH)3沉淀(2分);3.7~5.2 (2分) ;③(2分)
(4)蒸发浓缩(1分)、降温结晶(1分)、洗涤(1分)
本题解析:(1)由于双氧水不稳定,加热易分解生成氧气和水。由于在加入双氧水之前溶液的温度较高,所以加入3% H2O2之前必须进行冷却操作。由于亚铁离子沉淀的pH较大,所以必须将其氧化成铁离子沉淀,因此加入双氧水的目的是氧化亚铁离子,反应的离子方程式为2Fe2+ + H2O2 + 2H+= 2Fe3+ +2H2O。
(2)要得到胆矾,就必须除去溶液中的铁离子,则根据沉淀时的pH值可知,调节溶液pH的目的是使Fe3+完全转变成Fe(OH)3沉淀;铁离子完全沉淀时的pH=3.7,而铜离子开始沉淀时的pH=5.2,所以溶液的pH应调节到3.7~5.2之间。由于在调节pH的同时,不能引入杂质,因此应该选择氧化铜来调节溶液的pH,即答案选③。
(3)从溶液中析出胆矾晶体必须通过蒸发浓缩、降温结晶、过滤、洗涤、干燥等操作步骤。
本题难度:一般
2、选择题 在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s) Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是(? )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是(? )
A.n(Ca2+)增大
B.c(Ca2+)不变
C.n(OH-)增大
D.c(OH-)减小
参考答案:B
本题解析:在石灰乳悬浊液存在下列平衡:Ca(OH)2(s) Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,会发生反应:CaO+H2O= Ca(OH)2。由于消耗了溶剂水,所以Ca(OH)2会析出。n(Ca2+)、 n(OH-)减小,由于温度不变,所以c(Ca2+)、c(OH-)不变。因此选项为B。
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,会发生反应:CaO+H2O= Ca(OH)2。由于消耗了溶剂水,所以Ca(OH)2会析出。n(Ca2+)、 n(OH-)减小,由于温度不变,所以c(Ca2+)、c(OH-)不变。因此选项为B。
本题难度:一般
3、计算题 难溶电解质在水溶液里存在着电离平衡。在常温下,溶液里各离子浓度以它们的系数为方次的乘积是一个常数,该常数叫溶度积(Ksp)。例如FeS(s)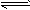 Fe2+(aq)+S2-(aq) ,Ksp = c(Fe2+)·c(S2-)=6.25×10-18 。溶液里各离子浓度幂的乘积,大于溶度积时则出现沉淀;反之沉淀溶解。试根据上述原理,计算:
Fe2+(aq)+S2-(aq) ,Ksp = c(Fe2+)·c(S2-)=6.25×10-18 。溶液里各离子浓度幂的乘积,大于溶度积时则出现沉淀;反之沉淀溶解。试根据上述原理,计算:
(1)求常温下FeS的溶解度________g/100g水)。(设饱和溶液的密度为1g·cm-3)
(2)求常温下H2S的饱和溶液中,c(H+)与c(S2-)间存在关系有[c(H+)]2·[c(S2-)]=1.0×10-22,在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)达到1mol/L,应调节溶液的pH为多少?(已知:lg2≈0.3)
参考答案:(1)2.2×10-8 g
(2)2.4
本题解析:
本题难度:一般
4、选择题 已知如下物质的溶度积常数:FeS,Ksp=6.3×10-18;CuS,Ksp=1.3×10-36;ZnS,Ksp=1.6×10-24。下列说法正确的是? ( )
A.同温度下,CuS的溶解度大于ZnS的溶解度
B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol·L-1
C.因为H2SO4是强酸,所以Cu2++H2S=CuS↓+2H+不能发生
D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂
参考答案:D
本题解析:根据Ksp的大小可知,CuS的溶解度最小,A错。B选项中c(Cu2+)=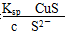 ,由于0.1 mol·L-1的H2S中,c(S2-)远远小于0.1 mol·L-1,故Cu2+浓度的最大值大于1.3×10-35mol·L-1,B错。C项中,由于CuS不溶于稀硫酸,故该反应可以发生,C错。D项中,根据FeS(s)
,由于0.1 mol·L-1的H2S中,c(S2-)远远小于0.1 mol·L-1,故Cu2+浓度的最大值大于1.3×10-35mol·L-1,B错。C项中,由于CuS不溶于稀硫酸,故该反应可以发生,C错。D项中,根据FeS(s) Fe2+(aq)+S2-(aq),由于Ksp(CuS)小于Ksp(FeS),故Cu2+会与S2-结合生成CuS,D正确。
Fe2+(aq)+S2-(aq),由于Ksp(CuS)小于Ksp(FeS),故Cu2+会与S2-结合生成CuS,D正确。
本题难度:一般
5、选择题 一定温度下,难溶强电解质的饱和溶液中存在着沉淀溶解平衡,其平衡常数为
物质
| Fe(OH)2
| Cu(OH)2
| Fe(OH)3
|
Ksp(25℃)
| 8.0×10
|
参考答案:
本题解析:
本题难度:一般