微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
|
上述盐溶液中的阴离子,结合H+能力最强的是_______ _,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100ml 0.1 mol/L NaHCO3 ②100ml 0.1 mol/L Na2CO3两种溶液,溶液中水电离出的H+个数:
① ②(填“>”、“=”或“<”,下同)。溶液中阴离子的物质的量浓度之和:① ②
(3)NaHCO3是一种 (填“强”或“弱”)电解质;写出HCO3
2、计算题 难溶电解质在水溶液里存在着电离平衡。在常温下,溶液里各离子浓度以它们的系数为方次的乘积是一个常数,该常数叫溶度积(Ksp)。例如FeS(s)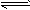 Fe2+(aq)+S2-(aq) ,Ksp = c(Fe2+)·c(S2-)=6.25×10-18 。溶液里各离子浓度幂的乘积,大于溶度积时则出现沉淀;反之沉淀溶解。试根据上述原理,计算:
Fe2+(aq)+S2-(aq) ,Ksp = c(Fe2+)·c(S2-)=6.25×10-18 。溶液里各离子浓度幂的乘积,大于溶度积时则出现沉淀;反之沉淀溶解。试根据上述原理,计算:
(1)求常温下FeS的溶解度________g/100g水)。(设饱和溶液的密度为1g·cm-3)
(2)求常温下H2S的饱和溶液中,c(H+)与c(S2-)间存在关系有[c(H+)]2·[c(S2-)]=1.0×10-22,在该温度下,将适量FeS投入H2S饱和溶液中,欲使溶液中c(Fe2+)达到1mol/L,应调节溶液的pH为多少?(已知:lg2≈0.3)
3、填空题 (15分)铜及其化合物与生产、生活关系密切。
(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,该反应中葡萄糖是 (填“氧化剂”或“还原剂”)
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4若将该反应设计成原电池,
正极的电极反应式为
(3)用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的部分流程如下:
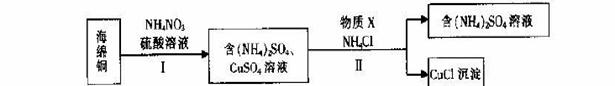
①步骤I中,反应温度不宜过高的原因是 。
②步骤I中,0.5 mol NH4NO3参加反应有4mol电子转移,铜参与反应的离子方程式为 。
③步骤II中,物质X可选用的物质是 。(填序号)。
a.Cu b.C12 c.H2O2 d.(NH4)2SO3
④步骤II中物质X需要过量的原因,其一是加快反应速率,其二是 _。
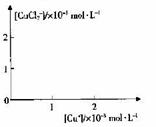
⑤步骤II中当NH4 Cl加到一定的量时,生成CuCl 会部分溶解生成CuCl2-在一定温度下建立两个平衡:
Cu Cl(s) 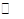 Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu Cl(s) + Cl一(a q)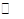 CuCl2(a q) K=0.35
CuCl2(a q) K=0.35
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2]-的关系曲线(要求至少标出坐标点)
4、选择题 在100 mL 0.01 mol·L-1 KCl溶液中,加入1 mL 0.01 mol·L-1 的AgNO3溶液,下列说法正确的是(已知AgCl的Ksp=1.8×10-10 mol2·L-2)
[? ]
A.有AgCl沉淀析出
B.无AgCl沉淀析出
C.无法确定
D.有沉淀但不是AgCl
5、填空题 (12分)
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Co(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 7.6
| 3.4
|
完全沉淀
| 4.1
| 9.7
| 9.2
| 5.2
|
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为? ? ??。
? ??。
(2)加入碳酸钠调节pH至a,a的范围是?;
(3)操作Ⅰ包含3个基本实验操作,它们是?、?和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是? ?。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是?(任写1点)。