微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 日本福岛核电站核泄漏引起的核辐射一度引起了人们的关注,尤其是碘元素引起了人们的格外关注。下面是关于碘的有关问题。
I.现向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。请回答下列问题:
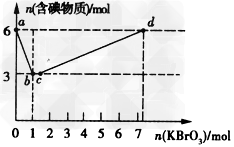
(1)b点时,KI反应完全,写出并配平a→b过程中发生反应的离子方程式:_______________________________。
(2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的化学方程式:____________________________________。
(3)①已知反应:2BrO3-+I2=2IO3-+Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由:__________________。
②n(KBrO3)=4.0mol时,对应含碘物质的化学式及其物质的量为___________。
Ⅱ.相同温度下,在四个密闭容器中发生可逆反应:H2(g)+I2(g)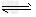 2HI(g),实验测得起始及平衡时的有关数据如表所示:
2HI(g),实验测得起始及平衡时的有关数据如表所示:
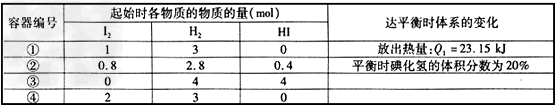
(4)下列叙述正确的是__________。
A.4个容器中反应的平衡常数相等
B.反应的热化学方程式为:H2(g)+I2(g)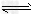 2HI(g) △H=-23.15kJ/mol
2HI(g) △H=-23.15kJ/mol
C.平衡时,容器④中H2的转化率高于①
D.容器②中达平衡时放出的热量Q2<23.15kJ
E.达到平衡后若将容器①的体积压缩,H2的转化率提高
(5)如果保持温度和压强不变,向容器③的平衡体系中加入1.6mol I2蒸气,平衡将____(填“正向”、“逆向”或“不”)移动,理由是________________________。
2、填空题 (15分)氢氧化镁用于制药工业,还是重要的绿色阻燃剂。
Ⅰ.治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2。
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子式方程式为 ;
Ⅱ.已知:
H2O(g)=H2(g)+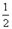 O2(g) △H1 =" +242" kJ·mol-1
O2(g) △H1 =" +242" kJ·mol-1
Mg(s)+2 H2O(g)=Mg(OH)2(s) + H2(g) △H2 =" -441" kJ·mol-1
Mg(s)+ 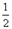 O2(g)="MgO(s) " △H3 = -602kJ·mol-1
O2(g)="MgO(s) " △H3 = -602kJ·mol-1
(2)氢氧化镁分解的热化学方程式为 ;
Ⅲ.某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制.获得阻燃剂氢氧化镁。
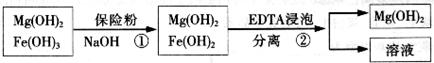
(3)步骤①中加入保险粉 的作用: 。
的作用: 。
(4)已知EDTA只能与溶液中的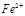 反应生成易溶于水的物质,不与
反应生成易溶于水的物质,不与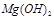 反应。虽然
反应。虽然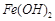 难溶于水,但步骤②中随着EDTA的加入,最终能够将
难溶于水,但步骤②中随着EDTA的加入,最终能够将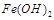 除去并获得纯度高的
除去并获得纯度高的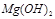 。请从沉淀溶解平衡的角度加以解释 ;
。请从沉淀溶解平衡的角度加以解释 ;
Ⅳ.为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如下:
精制阻燃剂的条件
| 阻燃剂铁含量
|
序号
| 提纯体系温度/℃
| 加入EDTA质量/g
| 加入保险粉质量/g
| W(Fe)/(10-4g)
|
1
| 40
| 0.05
| 0.05
| 7.63
|
2
| 40
| 0.05
| 0.10
| 6.83
|
3
| 60
| 0.05
| 0.10
| 6.83
|
4
| 60
| 0.10
| 0.10
| 6.51
|
(5)若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是 (填字母)。
①40℃ ②60℃ ③EDTA质量为O.05g
④EDTA质量为0.10g ⑤保险粉质量为0.05g ⑥保险粉质量为0.10g
A.①③⑤ B.②④⑥ C.①④⑥ D.②③⑤
3、选择题 某兴趣小组为探究外界条件对可逆反应A(g)+B(g)  C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
| A
| B
| C
|
Ⅰ
| 0.050 mol·L-1
| 0.050 mol·L-1
| 0.050 mol·L-1
|
Ⅱ
| 0.070 mol·L-1
| 0.070 mol·L-1
| 0.098 mol·L-1
|
Ⅲ
| 0.060 mol·L-1
| 0.060 mol·L-1
| 0.040 mol·L-1
|
Ⅳ
| 0.080 mol·L-1
| 0.080 mol·L-1
| 0.12 mol·L-1
|
针对上述系列试验,下列结论中错误的是 ( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20 mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与I比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,通过压缩容器的体积就可以实现
4、填空题 现有反应:mA(g)+nB(g)?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为______热反应,且m+n______p(填“>”“=”“<”).
(2)减压时,A的质量分数______.(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率______,B的转化率______.
(4)若升高温度,则平衡时B、C的浓度之比将______.
(5)若加入催化剂,平衡时气体混合物的总物质的量______.
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色______,而维持容器内压强不变,充入氖气时,混合物颜色______(填“变深”“变浅”或“不变”).
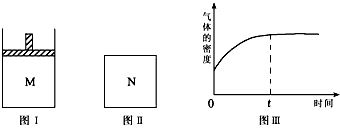
5、选择题 在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)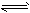 xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
[? ]
A.x=2
B.若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率