| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《水的电离平衡》在线测试(2017年最新版)(六)
参考答案:B 本题解析:硫酸是二元强酸,溶液中氢离子的浓度是0.12mol/L,所以硫酸是过量的,则反应后溶液中氢离子的浓度是 本题难度:一般 2、填空题 (12分)草酸与高锰酸钾在酸性条件下能够发生如下反应:
(2)对比实验Ⅰ和Ⅳ,可以研究 对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是 。 (3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O ①用托盘天平称取W g Na2C2O4晶体。 ②将WgNa2C2O4配成100 mL标准溶液,量取20.00 mL置于锥形瓶中, 酸性KMnO4溶液应装在________(填“酸式”或“碱式”)滴定管中。 ③若滴定管的起始读数和终点读数如图所示,则酸性KMnO4的物质的浓度为________ (填表达式,用W表示)。 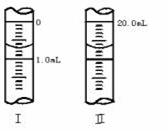 参考答案:(1)Ⅰ、Ⅱ ;Ⅰ、Ⅲ;(2)c(H+)(或硫酸溶液的浓度)确保所有实验中c(KMnO4)、c(H2C2O4)不变和溶液总体积不变(3)②酸式 ③2W/67mol·L-1 本题解析::(1)研究催化剂对反应速率的影响,需要其他条件相同;实验I和II 的实验中,Ⅱ中加硫酸锰是验证催化剂对反应速率的影响;研究温度变化需要改变温度探究反应速率变化,选择实验I和III,故答案为:I;II; I;III;(2)对比实验I和IV,硫酸体积不同,探究氢离子浓度对反应速率的影响,加入1ml水的目的是保持溶液总体积不变,改变硫酸溶液中氢离子浓度, 本题难度:困难 3、选择题 25 ℃时,取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为 |
参考答案:C
本题解析:混合后溶液显碱性,pH等于12,c(OH-)=10-2 mol·L-1,设浓度为c mol·L-1,NaOH和HCl溶液体积分别为3VL、2VL,则有:(3Vc-2Vc)/5V=10-2 mol·L-1,得c="0.05" mol·L-1
考点:有关溶液酸碱性的计算。
本题难度:一般
4、选择题 ①pH=0的盐酸②0.5mol·L-1盐酸③0.1mol·L-1的NH4Cl溶液④0.1mol·L-1的NaOH溶液⑤0.5mol·L-1的NH4Cl溶液,以上溶液中水电离的c(H+)由大到小的顺序是( )
A.⑤③④②①
B.①②③⑤④
C.①②③④⑤
D.⑤③④①②
参考答案:A
本题解析:pH=0的盐酸中 ,0.5mol·L-1盐酸中
,0.5mol·L-1盐酸中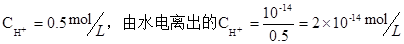 ,0.1mol·L-1的氢氧化钠溶液中
,0.1mol·L-1的氢氧化钠溶液中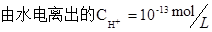 ,NH4Cl溶液中由于铵根离子的水解促进水的电离,,铵根离子的浓度越大促进的能力越强, 所以水电离的c(H+)大小关系为⑤大于③,综上溶液中水电离的c(H+)由大到小的顺序为⑤③④②①,答案选A。
,NH4Cl溶液中由于铵根离子的水解促进水的电离,,铵根离子的浓度越大促进的能力越强, 所以水电离的c(H+)大小关系为⑤大于③,综上溶液中水电离的c(H+)由大到小的顺序为⑤③④②①,答案选A。
本题难度:一般
5、填空题 (8分)下表是不同温度下水的离子积常数:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
参考答案:(1)> 水的电离程度增大,所以水的离子积增大
(2)1000 (3) 9:11 c(OH-)<c(H+)<c(SO42-)<c(Na+)
本题解析:(1)因为25℃时,Kww=1×10-14,t2℃,Kww=1×10-12,因为25<t1<t2,所以t1℃时,则1×10-12>a>1×10-14,这是因为温度升高,平衡向水电离的方向移动,水的电离程度增大,所以水的离子积增大。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L ,则该Na2SO4溶液中c(Na+)=1×10-3,稀释10倍后为1×10-4mol/L,c(OH-)=1×10-7mol/L,所以c(Na+)∶c(OH-)=1000,
(3) t2℃时, Kww=1×10-12,PH=11的NaOH溶液,C(OH-)="0.1mol/L," pH=1的稀硫酸溶液,C(H+)=0.1mol/L,酸、碱混合后溶液的PH=2,混合溶液呈酸性,所以[(0.1×V2)-(0.1×V1)]÷(V2+V1)=10-2,整理得V1:V2=9:11,该溶液为硫酸钠和硫酸的混合溶液,所以此溶液中各种离子的浓度由小到大的顺序是c(OH-)<c(H+)<c(SO42-)<c(Na+)。
考点:考查水的电离平衡及影响因素。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《电解池原理.. | |