微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知常温下CH3COOH的电离平衡常数为Ka。常温下,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是( )

A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、 d点表示的溶液中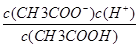 相等
相等
参考答案:C
本题解析:a点表示的溶液中由水电离出的c(H+)等于溶液中的c(OH-),即为1.0×10-11 mol/L,A正确。b点溶液呈酸性,即c(H+)>c(OH-),结合电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-)可得c(CH3COO-)>c(Na+),B正确。c点溶液呈中性,NaOH的量应不足,故C错误。c(CH3COO-)·c(H+)/c(CH3COOH)表示醋酸的电离平衡常数,温度不变则电离平衡常数不变,故D正确。
本题难度:一般
2、实验题 (1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者?后者(填“<”、“>”或“=”).
(2)在25℃条件下将pH=5的氯化铵溶液稀释100倍 ,稀释后溶液的pH为(填选项字母,下同)?.
,稀释后溶液的pH为(填选项字母,下同)?.
A.5? B.7 ?C.3~5之间? D.5~7之间
(3)将体积和物质的量浓度都相同的醋酸和氢氧化钠溶液混合后,溶液呈?性(填“酸”,“中”或“碱”,下同),溶液中c(Na+)?c(CH3COO-)(填“ >” 或“=”或“<”,下同 )。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈?性,溶液中c(Na+)?c(CH3COO-)
(5)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)?氢氧化钠溶液中c(OH-),m与n的大小关系是m?n。
(6)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是?。(多选、错选不得分)
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
E.未用标准液润洗碱式滴定管。
参考答案:(1)= (2) D (3)碱,?>;(4)酸,<;(5)<,>;(以上每空1分)
(6)A、D、E(多选、错选不得分)(2分)
本题解析:略
本题难度:简单
3、选择题 下列判断正确的是(?)
A.pH =6的溶液一定呈酸性
B.c(H+)水电离产生= c(OH-)水电离产生的溶液一定呈中性
C.使石蕊试液显红色的溶液一定呈酸性
D.强酸和强碱等物质的量混合后溶液一定呈中性
参考答案:C
本题解析:溶液酸碱性应决定于溶液中H+与OH-浓度的相对大小。而于溶液的pH、c(H+)水电离产生、c(OH-)水电离产生没有直接的关系,所以A、B错;另D中中和没有说明过量不足问题,也不能判断,错误。故答案为C。
本题难度:一般
4、选择题 夜间发现液化石油气泄漏时,应采取的紧急措施是
A.向室内喷水,溶解液化石油气,防止其燃烧
B.开灯,仔细检查泄漏源
C.打开所有门窗通风,关闭气源阀门
D.打电话报警,并请维修人员前来维修
参考答案:C
本题解析:试题分析:石油液化气泄漏会引发火灾和爆炸,避免火灾最好的办法是关闭气源阀门,并使空气流通,降低空气中石油液化气的浓度,从而避免火灾(或爆炸)发生。A、液化石油气不能溶解在水中,故A错;B、可燃性的气体与氧气或空气混合后点燃易发生爆炸,开灯会产生电火花,易引燃混合气体,发生危险,故B错;C、立即打开所有门窗通风,关闭气源阀门,会使室内空气对流,同时可以降低气体的温度和减小可燃性气体的浓度,使混合气体达不到着火点和爆炸极限,故C对;D、立即打电话报警,并请维修人员前来维修的措施不及时,故D错。故选C考点:本题考查常见的意外事故的处理方法;易燃物和易爆物安全知识点评:要熟记液化石油气泄露后的处理方法,一旦液化石油气泄露,要能在最短的时间内做出正确的处理方法。
本题难度:简单
5、选择题 99℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列叙述中不正确的是( )
A.此时水的离子积KW=1×10-14
B.水电离出的c(H+)=1×10-10mol·L-1
C.水的电离程度随温度升高而增大
D.c(Na+)=c(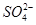 )
)
参考答案:A
本题解析:99℃时,蒸馏水的pH=6,说明Kw=1×10-12,因此温度升高水的电离程度增大。NaHSO4=Na++H++SO42-,pH=2,说明c(H+)=0.01mol/L,且都是NaHSO4电离的,所以水电离出的c(H+)=1×10-10mol·L-1。所以不正确的是A。
点评:水电离出的c(H+)和溶液中的c(H+)不同,如果溶液中的H+是酸电离的,则溶液中的OH-是水电离的,由此可以求出水电离出的c(H+)。
本题难度:一般