微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下的两种溶液:①pH=9的NaOH溶液,②pH=9的CH3COONa溶液。对这两种溶液的判断,正确的是
A.两溶液中水的电离程度相同
B.c(Na+):①>②
C.两溶液分别用水稀释10倍后,pH①=pH②<9
D.将①和②等体积混合后的溶液:c(Na+)=c(CH3COO-)+c(OH-)-c(H+)
参考答案:D
本题解析:A、氢氧化钠抑制水的电离,而醋酸钠水解促进水的电离,两溶液中水的电离程度②>①,A错误; B、①中钠离子的浓度近似等于氢氧根离子的浓度,即10-5mol/L,而醋酸钠溶液中醋酸根离子水解比较微弱,所以钠离子的浓度远远大于水解生成的氢氧根离子的浓度,故c(Na+):①<②;C、稀释时醋酸钠的水解平衡向右移动,故pH①<pH②但都大于9,故C错误;D项中将氢离子移向左边,再根据溶液中的电荷守恒可判断D正确;故选D。
本题难度:一般
2、选择题 室温下,将1.000mol
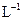 盐酸滴入20.00mL 1.000mol
盐酸滴入20.00mL 1.000mol
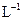 氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。下列有关说法正确的是?
氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。下列有关说法正确的是?
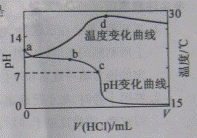
A.a点由水电离出的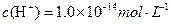
B.b点: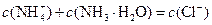
C.c点: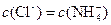
D.d点后,容易温度略下降的主要原因是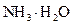 电离吸热
电离吸热
参考答案:C
本题解析:略
本题难度:一般
3、选择题 在25℃时, 0.1mol·L-1的HX溶液中,c (OH-)/c (H+) =1×10—6,在该条件下对0.1mol·L-1的HX溶液,下列说法中正确的是
A . HX的电离方程式为:HX=H+ + X— ?
B?此溶液的pH=1
C.该溶液中c(HX)> c (H+)> c (X-)>c (OH-) ?
D.与PH=10的NaOH溶液等体积混合溶液呈中性
参考答案:C
本题解析:c (OH-)/c (H+) =1×10—6,10-14/10-6=c(H+)2,得c (H+) =1×10—4 mol·L-1,HX为弱酸。
A .不正确,HX是弱电解质,它的电离方程式为:HX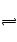 H+ + X—
H+ + X—
B?不正确,c (H+) =1×10—4 mol·L-1,此溶液的pH=4
C.正确,该溶液中c(HX)> c (H+)> c (X-)>c (OH-) ?
D.不正确,与PH=10的NaOH溶液等体积混合溶液呈酸性,酸浓度大,NaOH不足。
选C。
本题难度:一般
4、计算题 标准状况下,一个装满O2的容器的质量为79g,若装满氮气时质量是71g,盛满某气体X时,质量为103g。试计算:
⑴此容器的容积
⑵气体X的相对分子质量。
⑶该状况下该容器中盛满氯气时的总质量。
参考答案:⑴44.8L? ⑵44? ⑶157g
本题解析:(1)假设容器的体积为VL,质量为m,
则有:m+[VL/(22.4L/mol)]×32g/mol=79g,m+[VL/(22.4L/mol)]×28g/mol=71g,
解之得:V=44.8,m=15g,
答:此容器的容积为44.8L。
(2)盛满某气体X时,质量为103g,设气体X的摩尔质量为M,
则有:15g+[44.8L/(22.4L/mol)]×M=103,
解之得:M=44g/mol,
答:气体X的摩尔质量为44g/mol。
(3)在标况下该容器中盛满氯气时的总质量为:15g+[44.8L/(22.4L/mol)]×71g/mol=157g,
答:在标况下该容器中盛满二氧化碳时的总质量为157g。
点评:本题考查物质的量的相关计算,题目难度不大,注意求解容器的体积和质量为解答该题的关键。
本题难度:一般
5、计算题 (8分)25℃时,将体积Va,pH=a的某一元强碱与体积为Vb,pH=b的某二元强酸混合。
(1)若所得溶液的pH=11,且a=13,b=2,则Va︰Vb=??。
(2)若所得溶液的pH=7,且已知Va>Vb,b=0.5a,b值可否等于4 ?(填“可”或“否”)
(3)为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg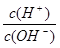 。
。
25℃时,若溶液呈中性,则AG= ??,溶液的pH与AG的换算公式为AG= ??(要简化)。
参考答案:(1)? 1: 9? (2) 可? (3)? 0? -2pH+14
本题解析:(1)混合后溶液pH为11,说明碱过量,则
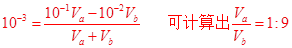
(2)强酸强碱恰好中和则符合公式:

故b值可以等于4
(3)25℃时,若溶液呈中性,则c(H+)=c(OH—),代入AG=lg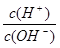 =0
=0
AG=lg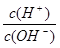 =
=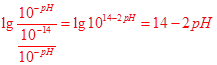
本题难度:一般