微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 盐酸与碳酸钙固体反应时,下列措施能使最初的反应速率明显加快的是( )
A.增加碳酸钙的量
B.盐酸的用量增加一倍
C.盐酸的用量减半,浓度加倍
D.温度升高
参考答案:A、增加碳酸钙的量,并不改变浓度,反应速率不变,故A错误;
B、盐酸的用量增加一倍,并不改变浓度,反应速率不变,故B错误;
C、盐酸的用量减半,浓度加倍,反应速率加快,故C正确;
D、温度升高,化学反应速率加快,故D正确;
故选:CD.
本题解析:
本题难度:一般
2、选择题 对于反应N2+O2?

2NO在密闭容器中进行,下列哪些条件能加快反应的速率( )
A.缩小体积使压强增大
B.体积不变充入N2使压强增大
C.体积不变充入H2使压强增大
D.压强不变充入稀有气体氖
参考答案:A.缩小体积,反应物的浓度增大,反应速率增大,故A正确;
B.体积不变充入N2使压强增大,反应物的浓度增大,反应速率增大,故B正确;
C.体积不变充入H2使压强增大(不考虑氢气与氧气的反应),但参加反应的物质的浓度不变,反应速率不变,
D.压强不变充入稀有气体氖,体积增大,反应物的浓度减小,则反应速率减小,故D错误.
故选AB.
本题解析:
本题难度:一般
3、选择题 设C+CO2 2CO(吸热反应)反应速率为u1,N2+3H2
2CO(吸热反应)反应速率为u1,N2+3H2 2NH3(放热反应)反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为
2NH3(放热反应)反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为
[? ]
A.同时增大
B.同时减小
C.增大,减小
D.减小,增大
参考答案:A
本题解析:
本题难度:简单
4、实验题 H2O2是实验室常用的一种化学试剂。某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号
| 反应物
| 催化剂
|
①
| 10mL2% H2O2溶液
| 无
|
②
| 10mL5% H2O2溶液
| 无
|
③
| 10mL5% H2O2溶液
| 1mL0.1mol·L-1FeCl3溶液
|
④
| 10mL5% H2O2溶液+少量HCl溶液
| 1mL0.1mol·L-1FeCl3溶液
|
⑤
| 10mL5% H2O2溶液+少量NaOH溶液
| 1mL0.1mol·L-1FeCl3溶液
|
(1)实验①和②的目的是_ ,
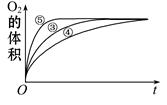
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。分析下图能够得出的结论是 。
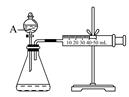
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如下图所示的实验装置进行实验。
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是 。
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为 ;
参考答案:(8分)(1)探究H2O2溶液的浓度的变化对分解速率的影响。
(2)图像显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱。
(3)测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率。
(4)Fe2++2H2O2+4H+= Fe3++4H2O
本题解析:(1)根据表中数据可知,实验①②中不同之处在于双氧水的浓度不同,所以实验目的是探究H2O2溶液的浓度的变化对分解速率的影响。
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,即实验结论是图像显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱。
(3)要比较Fe3+和Cu2+对H2O2分解的催化效果,应在相同的条件下利用一个变量来比较,同时还需要测量测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率。
(4)双氧水具有氧化性,能把亚铁离子氧化生成铁离子,反应的离子方程式是Fe2++2H2O2+4H+=Fe3++4H2O。
考点:考查影响化学反应速率因素的实验探究
点点评:该题是中等难度的试题,试题综合性强,侧重对学生实验探究能力的培养,有利于激发学生的学习积极性,也有助于培养学生的规范实验设计能力。所以该类试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该题能较好的考查学生实验设计、数据处理、图象分析的综合能力。在解答时注意已知信息的利用。
本题难度:困难
5、选择题 100mL?6mol?L-1?H2SO4?跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.碳酸钠固体
B.硝酸钠
C.硫酸钾固体
D.醋酸钠固体
参考答案:A.加入碳酸钠固体,与硫酸反应,导致反应物浓度降低,反应速率减小,但硫酸物质的量减小,影响生成氢气的总量,故A错误;
B.加入硝酸钠,在酸性条件下,NO3-具有强氧化性,与Zn反应生成NO,不生成氢气,故B错误;
C.加入硫酸钾固体,溶液浓度不变,反应速率和氢气的总量都不受影响,故C错误;
D.加入醋酸钠固体,生成弱电解质醋酸,溶液氢离子浓度减小,反应速率减小,但不影响生成氢气的总量,故D正确.
故选D.
本题解析:
本题难度:一般