|
高考化学知识点整理《原电池原理》试题强化练习(2017年最新版)(六)
2017-08-06 10:44:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在如图所示的原电池中,下列说法正确的是( )
A.负极发生还原反应
B.正极反应为?Cu-2e-Cu2+
C.电子由锌片通过导线流向铜片
D.该装置能将电能转化为化学能
| 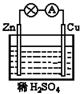
参考答案:A.该原电池中,负极是锌,放电时,锌失电子发生氧化反应,故A错误;
B.正极上,氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故B错误;
C.电子从负极锌沿导线流向正极铜,故C正确;
D.该装置是将化学能转变为电能的装置,是原电池,故D错误;
故选C.
本题解析:
本题难度:简单
2、选择题 由NaCl和CuSO4组成的混合溶液中C(Na+)=3(Cu2+)=0.3 mol·L-1,取该混合液100 mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112 L(标准状况)气体.若溶液体积仍为100 mL,此时溶液的pH为
A.14
B.2
C.12
D.13
参考答案:D
本题解析:
本题难度:困难
3、选择题 根据右图装置判断下列说法错误的是(?)

A.铜片上有气泡产生
B.铜片上发生氧化反应
C.锌片为负极
D.该装置将化学能转化为电能
参考答案:B
本题解析:此装置为铜锌原电池装置。将化学能转化为电能,其中锌为负极:Zn- 2e=Zn2+,发生氧化反应;铜为正极:2H+ +2e=H2,发生还原反应。故答案为B 。
点评:本题考查了原电池原理,难度不大,注意从氧化还原反应的电子得失来判断原电池电极反应式的书写。
本题难度:一般
4、选择题 在理论上可用于设计原电池的化学反应是( )
A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(aq)+3H2(g);△H<0
B.Ba(OH)2?8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3?H2O(aq)+8H2O(1);△H>0
C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H<0
D.FeCl3(aq)十3H2O(1)?Fe(OH)3(s)+3HCl(aq);△H>0
参考答案:A、是放热反应,是氧化还原反应,能设计成原电池,故A正确;
B、属于复分解反应,是吸热反应,不是氧化还原反应,不能设计成原电池,故B错误 ;
C、属于复分解反应,是吸热反应,不是氧化还原反应,不能设计成原电池,故C错误;
D、属于复分解反应,是吸热反应,不是氧化还原反应,不能设计成原电池,故D错误;
故选A.
本题解析:
本题难度:简单
5、计算题 按要求完成下列各小题。
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为: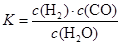
它所对应的化学方程式为: 。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。
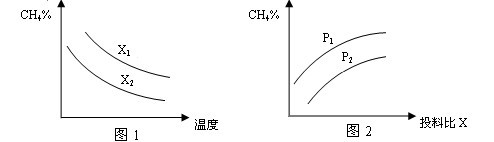
①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:
。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va
参考答案:
本题解析:
本题难度:困难
| 