微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某含铬Cr2O72-废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是?(?)
A.消耗硫酸亚铁铵的物质量为n(2-x)mol
B.处理废水中Cr2O72-的物质量为mol
C.反应中发生转移的电子数为3nx mol
D.在FeO·FeyCrxO3中3x=y
参考答案:A
本题解析:A项:消耗硫酸亚铁铵的物质的量为n(y+1),又由FeO·FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁铵的物质的量为n(3-x);
B项:Cr元素nxmol,故Cr2O72-的物质的量为nx/2;
C项:得到nmolFeO·FeyCrxO3,则一共有nx molCr参加反应,1molCr转移电子3mol,且仅Cr失电子,故转移的电子数为3nxmol;
D项:FeO·FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y
故选A。
本题难度:一般
2、选择题 下列各组物质反应后,再滴入KSCN溶液,显红色的是
A.过量铁和稀盐酸
B.FeCl2溶液和氯水
C.过量铁和CuCl2溶液
D.过量铁和FeCl3溶液
参考答案:B
本题解析:
正确答案:B
A、Fe+2HCl=FeCl2+H2↑无Fe3+ 产生;
B. FeCl2溶液和氯水,2Fe2++Cl2=2Fe3++2Cl―有Fe3+产生
C.过量铁和CuCl2溶液:Fe+Cu2+=Fe2+Cu无Fe3+ 产生;
D.过量铁和FeCl3溶液?:2Fe3++Fe=3Fe2+?无Fe3+ 产生;
本题难度:简单
3、选择题 下列各图示中能较长时间看到Fe(OH)2白色沉淀的是? ( )。

A.①②③④⑤
B.①②③⑤
C.①②③④
D.②③④⑤
参考答案:B
本题解析:因为Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,即发生4Fe(OH)2+O2+2H2O=4Fe(OH)3。因此要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。①、②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③的原理为铁作阳极产生Fe2+,与电解水产生的OH-结合生成Fe(OH)2,且液面用汽油保护,能防止空气进入;⑤中液面加苯阻止了空气进入;④由于空气中的氧气,能迅速将Fe(OH)2氧化,因而不能较长时间看到白色沉淀。
本题难度:一般
4、计算题 在500g稀硝酸中投入48g铁粉,若两种物质恰好完全反应(还原产物为NO)。求:
(1)稀HNO3的质量分数?
(2)被还原的硝酸的物质的量?
参考答案:(1)若铁不过量,则生成物为Fe(NO3)3
设HNO3的质量为x
Fe? +? 4HNO3====Fe(NO3)3+NO↑+2H2O
56g?252g
48g?x
x=(252g×48g)/56g=216g
HNO3的质量分数=216g/500g×100%=43.2%


(2)若铁过量,Fe(NO3)3全部被还原,则生成物为Fe(NO3)2。
设HNO3的质量为y
3Fe? +? 8HNO3====3Fe(NO3)2+2NO↑+4H2O
168g?504g
48g?y
y=(504q×48g)/168g=144g
HNO3的质量分数=144g/500g×100=28.8%
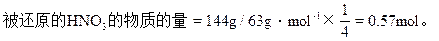
因此硝酸的质量分数为28.8%≤HNO3%≤43.2%
被还原的硝酸的物质的量为0.57mol≤被还原的HNO3的物质的量≤0.857mol。
本题解析:本题考查了学生的审题能力。本题看上去简单,实际上很复杂。这是因为硝酸与铁反应时,两者相对量的不同,最终生成物也不一样。若铁与硝酸适量完全反应,则生成Fe(NO3)3;若铁过量,则生成的Fe(NO3)3要与铁反应,而最终生成Fe(NO3)2,第一种情况,消耗硝酸较多,第二种情况消耗的硝酸的量较少(因为铁的质量一定)。若消耗的硝酸的量介于两者之间,即过量不多,则生成和中既有Fe(NO3)2,又有Fe(NO3)3。因此,本题计算的结果不是确定值,而是在一定的范围内,故可分两种情况讨论。
本题难度:一般
5、选择题 向一定量的Fe、FeO和Fe2O3的混合物中加入240 mL4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出2.688L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气还原相同质量的混合物,能得到铁的物质的量(?)
A.0.48 mol
B.0.42mol
C.0.32 mol
D.0.28 mol
参考答案:B
本题解析:根据题意可知,生成物全部是硝酸亚铁。被还原的硝酸是2.688L÷22.4L/mol=0.12mol,所以没有被还原的硝酸是0.96mol-0.12mol=0.84mol,则生成硝酸亚铁是0.42mol,所以最终生成的铁的物质的量是0.42mol,答案选B。
本题难度:一般