微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如下图所示。下列说法不正确的是
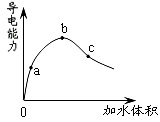
A.在0点时,醋酸不导电
B.a、b、c三点,a点时醋酸溶液中H+浓度最小
C.b点时,醋酸电离程度最大
D.可通过微热的方法使c点溶液中c(CH3COO-)增大
参考答案:C
本题解析:在0点时,醋酸不导电,导电能力为b>c>a, a、b、c三点,a点时醋酸溶液中H+浓度最小; b点时,醋酸电离程度不是最大,加水促进醋酸电离。加热向电离方向移动,D正确。C错误。
本题难度:一般
2、选择题 在100ml下列溶液中,分别加入0.05molNaOH固体,溶液的导电性变化不大的是
A.蒸馏水
B.0.5mol/L的CH3COOH
C.0.5mol/L的HCl
D.0.5mol/L的氨水
参考答案:C
本题解析:溶液的导电性强弱主要和溶液中离子浓度大小以及离子的电荷数有关系。离子浓度越大,电荷数越多,溶液导电性越强。A中离子浓度增加,导电性增强;B中有强电解质醋酸钠生成,导电性增强;C中生成氯化钠,导电性变化不大;D中离子浓度增大,导电性增强,答案选C。
点评:该题的关键是理解溶液的导电性和离子的种类、个数多少无关系。主要是看溶液中离子浓度的大小和离子电荷数,据此可以判断。同时还需要熟练记住常见的强电解质。
本题难度:一般
3、填空题 (14分)元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩:
⑴在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。与铜相比,其金属活泼性?。(填“强”或“弱”)
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是?。
(3)工业上净化处理铬污染方法之一:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[ Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 ?mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为贵重金属之一。
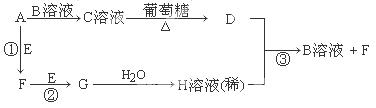
请回答下列问题:
(1)A分子是?分子(填“极性”或“非极性”),C溶液中的阳离子是?(写化学式,不考虑水的电离)。
(2)反应①的化学方程式为?;反应③的离子方程式为?。
参考答案:Ⅰ.(1)强;(2)Cr( OH)3 H+ + CrO2—+ H2O;(3)3.0×10-6;
H+ + CrO2—+ H2O;(3)3.0×10-6;
Ⅱ.(1)极性;[Ag(NH3)2]+;
(2)4NH3+5O2 ?4NO+6H2O;
?4NO+6H2O;
3Ag + 4H+ + NO3—= 3Ag+ + NO↑+ 2H2O
本题解析:Ⅰ(1)在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液,而铜与稀硫酸不反应,说明铬的活泼性强于铜。(2)Cr(OH)3和Al(OH)3类似,由Al(OH)3的酸式电离可知,Cr(OH)3的酸式电离方程式是:Cr(OH)3 H++CrO2-+H2O;(3)电解后溶液中c(Fe3+)=2.0×10-13mol/L,则溶液中c3(OH-)=4×10?38/2.0×10-13 =2×10-25,故溶液中c(Cr3+)=6.0×l0-31/2×10-25 =3×10-6mol/L;Ⅱ、C溶液与葡萄糖在加热条件下生成金属D,则D为Ag、C为银氨溶液,气体A与溶液B得到银氨溶液,则A为NH3、B为AgNO3,Ag与溶液H反应得到硝酸银与气体F,则H为HNO3,逆推可知G为NO2,F为NO,E为O2。(1)A为NH3,所含化学键均为极性键,空间构型为三角锥形,属于极性分子; C溶液中的阳离子为[Ag(NH3)2]+;(2)反应①的化学方程式为4NH3+5O2
H++CrO2-+H2O;(3)电解后溶液中c(Fe3+)=2.0×10-13mol/L,则溶液中c3(OH-)=4×10?38/2.0×10-13 =2×10-25,故溶液中c(Cr3+)=6.0×l0-31/2×10-25 =3×10-6mol/L;Ⅱ、C溶液与葡萄糖在加热条件下生成金属D,则D为Ag、C为银氨溶液,气体A与溶液B得到银氨溶液,则A为NH3、B为AgNO3,Ag与溶液H反应得到硝酸银与气体F,则H为HNO3,逆推可知G为NO2,F为NO,E为O2。(1)A为NH3,所含化学键均为极性键,空间构型为三角锥形,属于极性分子; C溶液中的阳离子为[Ag(NH3)2]+;(2)反应①的化学方程式为4NH3+5O2 ?4NO+6H2O;反应③的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。sP的计算、物质的推断及化学方程式的书写。
?4NO+6H2O;反应③的离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O。sP的计算、物质的推断及化学方程式的书写。
本题难度:一般
4、选择题 可以说明乙酸是弱酸的事实是
A.乙酸不能使酚酞溶液变红色
B.乙酸和Na2CO3反应可放出CO2
C.乙酸能使紫色石蕊试液变红色
D.0.1 mol·L-1的乙酸溶液pH>1