|
|
|
高中化学知识点讲解《热化学方程式》考点预测(2017年强化版)(二)
2017-08-08 03:55:42
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 不管化学反应过程是一步完成还是分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)===H2O(l) ΔH1=-Q1 kJ·mol-1①
C2H5OH(g)===C2H5OH(l) ΔH2=-Q2 kJ·mol-1②
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-Q3 kJ·mol-1③
若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为( )
A.(Q1+Q2+Q3) kJ
B.[0.5(Q1+Q2+Q3)] kJ
C.(0.5Q1-1.5Q2+0.5Q3) kJ
D.(1.5Q1-0.5Q2+0.5Q3) kJ
|
参考答案:D
本题解析:根据盖斯定律,将【③式+②式-(3×①式)】就得到46克酒精液体完全燃烧,最后恢复到室温的情况,将ΔH数值代入计算即可知道D选项正确。
考点:盖斯定律的应用
点评:掌握盖斯定律的概念。
本题难度:一般
2、填空题 研究NO2.SO2.CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,也可用NH3处理,也可用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下2.24L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(2)已知:2SO2(g)+O2(g) 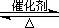 2SO3(g) ?H=-196.6 kJ·mol-1 2SO3(g) ?H=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ?H=-113.0 kJ·mol-1 2NO2(g) ?H=-113.0 kJ·mol-1
(
参考答案:
本题解析:
本题难度:困难
3、填空题 氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)500°C、50Mpa时,在容积为VL的密闭容器中加入n mol N2、3n mol H2,经过t min后反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值
为 ; t min内用NH3表示的速率是
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol 2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol
参考答案:(6分)(1)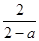 (2分);2an / Vtmol·L-1·min-1(2分) (2分);2an / Vtmol·L-1·min-1(2分)
(2)436.1kJ/mol (2分)
本题解析:(1) N2(g)+3H2(g) 2NH3(g) 2NH3(g)
起始量(mol) n 3n 0
转化量(mol) na 3na 2na
平衡量(mol) n-na 3n-3na 2na
所以容器内气体的压强反应前与平衡时的比值为
t min内用NH3表示的速率是 =2an / Vtmol·L-1·min-1 =2an / Vtmol·L-1·min-1
(2)反应热就是断键吸收的能量和形成新化学键时所放出的能量的差值,则945.6kJ/mol+3×x-2×3×391.0kJ/mol=-92.2 KJ/mol,解得x=436.1kJ/mol。
考点:考查反应速率和反应热的有关计算
点评:该题是基础性试题的考查,难度不大。主要是考查学生对教材基础知识的熟悉了解程度,旨在巩固学生的基础,提高学生的能力。有利于培养学生的逻辑推理能力和规范的答题能力。该题的关键是明确反应速率的会议以及反应热的计算依据,然后结合题意灵活运用即可。
本题难度:一般
4、选择题 已知热化学方程式:
① C2H2(g) +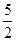 O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1 O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1
② C(s)+ O2(g) == CO2(g) △H2=-393.5 kJ?mol-1
③ H2(g)+ 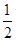 O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1 O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1
则反应④ 2C(s)+ H2(g) == C2H2(g)的△H为( )
A.+228.2 kJ·mol-1
B.-228.2 kJ·mol-1
C.+1301.0 kJ·mol-1
D.+621.7 kJ·mol-1
|
参考答案:A
本题解析:根据盖斯定律可知,②×2+③-①即得到反应④ 2C(s)+ H2(g) == C2H2(g),所以该反应的△H=-393.5 kJ?mol-1×2-285.8 kJ·mol-1+1301.0 kJ?mol-1=+228.2 kJ·mol-1,答案选A。
考点:考查反应热的有关计算。
点评:根据热化学方程式计算反应热时,一般依据盖斯定律进行。
本题难度:一般
5、填空题 25°C (1.01×105)Pa下,4g CO在氧气中燃烧生成CO2,放出 9. 6kJ热量,写出CO燃烧的
(1)反应方程式_____________________________________________________ ;
(2)热化学反应方程式___________________________________________________。
参考答案:(1)2CO+O2 2CO2(2)2CO(g) + O2(g) == 2CO2(g) ;△H = -134.4 KJ/mol
2CO2(2)2CO(g) + O2(g) == 2CO2(g) ;△H = -134.4 KJ/mol
本题解析:
本题难度:一般
 2CO2(2)2CO(g) + O2(g) == 2CO2(g) ;△H = -134.4 KJ/mol
2CO2(2)2CO(g) + O2(g) == 2CO2(g) ;△H = -134.4 KJ/mol