微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
?
(1)T的原子结构示意图是______。用化学方程式表示工业常用冶炼T单质的原理是______。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中存在的共 价键的类型是______。
(3)元素的非金属性:Q______W(填“强于”或“弱于”),结合方程式简述其原因是______。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应水化物,实验步骤:将盛有甲的试管倒扣在水槽中,______。
参考答案:(1)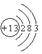 ?2Al2O3
?2Al2O3 ?4Al+3O2↑
?4Al+3O2↑
(2)极性键和非极性键
(3)弱于? CO32—+H2O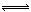 HCO3—+OH— ,碳酸根水解,而硫酸根不发生水解
HCO3—+OH— ,碳酸根水解,而硫酸根不发生水解
(4)向试管中缓缓通入足量氧气
本题解析:由短周期元素及图可知,则Q、R在第二周期,T所处的周期序数与主族序数相等,则T在第三周期第ⅢA族,即T为Al,依次推出Q为C,R为N,W为S。
(1)T为Al,原子结构中有3个电子层,最外层电子数为3,原子结构示意图为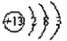
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子为H2O2,该分子存在的化学键类型为:极性键和非极性键。
(3)根据Na2CO3溶液显酸性,Na2SO4溶液为中性,碳的非金属性弱于硫的非金属性;CO32?水解反应离子方程式为:CO32—+H2O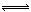 HCO3—+OH— ,碳酸根水解,而硫酸根不发生水解。
HCO3—+OH— ,碳酸根水解,而硫酸根不发生水解。
(4)甲是R的氧化物,通常状况下呈红棕色,为NO2,向试管中缓缓通入足量氧气,发生反应:4NO2+O2+2H2O=4HNO3,可全部转化为HNO3。
本题难度:一般
2、填空题 (12分)①~⑧是元素周期表中的部分元素。
 族 族
周期
| IA
| ?
| 0
|
1
| ①
| IIA
| IIIA
| IVA
| VA
| VIA
| VIIA
| ?
|
2
| ?
| ?
| ?
| ②
| ?
| ③
| ④
| ?
|
3
| ⑤
| ⑥
| ⑦
| ?
| ?
| ?
| ⑧
| ?
|
请回答:
(1)元素③④⑧的气态氢化物中最稳定的是__________(填化学式)。
(2)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是__________。
(3)元素⑥和⑧形成的化合物的电子式是__________。
(4)某同学为了比较元素②和硅元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。请回答:
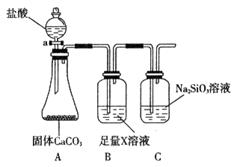
a. X是__________(填化学式),B装置的作用是__________。
b. 能说明元素②和硅元素非金属性强弱的实验现象是__________,相关的化学方程式是__________。同主族元素从上到下__________,得电子能力逐渐减弱,非金属性逐渐减弱。
(5)请设计实验比较元素⑥与⑦金属性的相对强弱__________。
参考答案:(1)HF(1分,写F不给分)
(2) (2分,写化学方程式或没配平不给分)
(2分,写化学方程式或没配平不给分)
(3)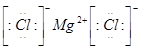 (1分)?(4)a.
(1分)?(4)a. 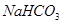 (1分)
(1分)
吸收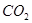 中混有的
中混有的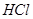 气体(1分)? b. C中产生白色胶状沉淀(1分)
气体(1分)? b. C中产生白色胶状沉淀(1分)
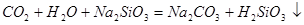 (2分,写
(2分,写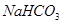 、离子方程式均给分)
、离子方程式均给分)
电子层数逐渐增加,原子半径逐渐增大(1分,任答一点即可)
(5)取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象。(2分,未注明酸浓度相同扣1分,其他合理答案,如与热水、原电池、最高价氧化物的水化物的碱性比较等酌情给分,但答成原理不给分)
本题解析:考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知,①~⑧分别是H、C、O、F、Na、Mg、Al、Cl。
(1)非金属性越强相应氢化物的稳定性越强,所以应该是HF。
(2)氢氧化铝是两性氢氧化物,能溶于氢氧化钠中,方程式为 。
。
(3)镁和氯都是活泼的金属和非金属,二者形成的化学键是离子键,电子式为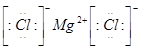
(4)A装置是产生CO2的,但由于生成CO2分子中含有氯化氢,而氯化氢也能和硅酸钠反应,所以需要除去CO2中的氯化氢,因此X是碳酸氢钠,原来吸收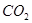 中混有的
中混有的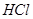 气体;同主族元素从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。因此C的非金属性强于硅的,则CO2就能制取硅酸,所以实验现象就是C中产生白色胶状沉淀,方程式为
气体;同主族元素从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。因此C的非金属性强于硅的,则CO2就能制取硅酸,所以实验现象就是C中产生白色胶状沉淀,方程式为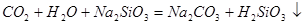 。
。
(5)考查金属性强弱比较。比较元素金属性强弱的依据可以是
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
即取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象。
本题难度:一般
3、实验题 某学生在做元素性质与原子结构关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的
探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳
(3)实验内容(在下表横线中填写相关内容)
序号
| 实验方案
| 实验现象
|
①
| 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置
| 液体分为两层,下层呈_____色
|
②
| 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置
| 液体分为两层,下层呈_____色
|
?
(4)实验结论:_________________________________。
(5)问题和讨论
①上述两个实验中发生反应的离子方程式分别为________________、__________________。
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯的强:______________、______________。
参考答案:(3)①橙红 ②紫红
(4)同主族元素从上到下,元素原子的得电子能力逐渐减弱
(5)①Cl2+2Br-=Br2+2Cl- 2I-+Br2=2Br-+I2
②HF的稳定性比HCl的强 F2能置换出水中的氧,而Cl2不能置换出水中的氧(其他合理答案也可)
本题解析:向溴化钠溶液中加入新制氯水,发生反应:Cl2+2Br-=Br2+2Cl-,证明氧化性:Cl2>Br2;再加入四氯化碳后,振荡静置,溶液分层,上层近无色,下层呈橙红色。向碘化钠溶液中加入新制溴水,发生反应:Br2+2I-=I2+2Br-,证明氧化性:Br2>I2;再加入四氯化碳后,振荡静置,溶液分层,上层近无色,下层呈紫红色。两个实验说明:同主族元素从上到下,元素原子的得电子能力逐渐减弱。
本题难度:一般
4、选择题  已知X、Y元素同周期,且得电子能力X>Y,下列说法正确的是
已知X、Y元素同周期,且得电子能力X>Y,下列说法正确的是
A.最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性
B.在元素周期表中X位于Y的左面
C.Y的气态氢化物的稳定性大于X的气态氢化物的稳定性
D.X与Y形成的化合物中,X显负价,Y显正价
参考答案:D
本题解析:X、Y元素同周期,且得电子能力X>Y,说明X位于Y的右侧,即非金属性强于X的。所以选项D是正确的。
本题难度:简单
5、选择题 短周期元素X、Y、Z的原子序数依次增大,Y为IA族元素,X与Z同主族,3种元素原子的最外层电子数之和为13,下列判断正确的是
A.Y元素位于第2周期
B.Y、Z均能与X形成不只一种化合物
C.X是ⅤA族元素
D.氢化物的稳定性:HnZ > HnX
参考答案:B
本题解析:根据题意可知:X是O;Y是Na;Z是S。A.Na在元素周期表中位于第三周期第IA族。错误。B.O与Na可形成Na2O、Na2O2;S与Na可形成Na2S、Na2Sx等多种化合物。正确。C.O是第VIA族的元素;错误。D.元素的非金属性越强,其对应的氢化物的稳定性就越强。由于元素的非金属性O>S,所以氢化物的稳定性:H2O > H2S。错误。
本题难度:一般