微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是__________________________.
(2)铝与氢氧化钾溶液反应的离子方程式是?.
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.

①该电解槽的阳极反应式是___________________.
②通电开始后,阴极附近溶液pH会增大,请简述原因__________ .
③除去杂质后的氢氧化钾溶液从出口______(填写“A”或“B”)导出。
2、计算题 将镁、铝的混合物7.8 g溶于100 mL 6 mol/L的H2SO4溶液中,然后再滴加2 mol/L的NaOH溶液。请回答:
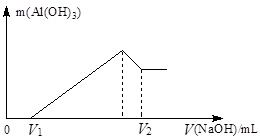
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积V变化如下图所示。当V1=200 mL时,则金属粉末中,n(Mg)=_________mol,V2=__________mL。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、A13+刚好沉淀完全,则滴入NaOH溶液的体积为__________mL。
3、选择题 将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。.则下列说法不正确的是
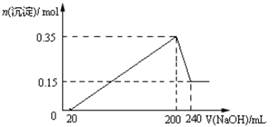
A.镁和铝的总质量为9 g
B.最初20 mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L-1
D.生成的氢气在标准状况下的体积为11.2 L
4、选择题 下列物质的转化在给定条件下能实现的是
①SiO2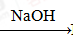 Na2SiO3
Na2SiO3 H2SiO3? ②Fe
H2SiO3? ②Fe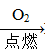 Fe2O3
Fe2O3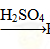 Fe2(SO4)3
Fe2(SO4)3
③BaSO4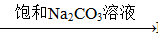 BaCO3
BaCO3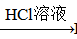 BaCl2 (Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9)
BaCl2 (Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=2.6×10-9)
④AlCl3溶液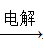 Al
Al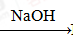 NaAlO2
NaAlO2
⑤HCHO HCOOH
HCOOH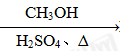 HCOOCH3
HCOOCH3
A.①②⑤
B.②③④
C.②④⑤
D.①③⑤
5、选择题 某同学用回收的镁铝合金制取氢气。现有10.8 g镁铝合金,下列说法正确的是(?)
A.常温下与足量18mol/LH2SO4反应,最多可放出0.6 mol H2
B.常温下与足量2mol/LHNO3反应,最少可放出0.45 mol H2
C.常温下与足量2 mol/L H2SO4反应,放出H2的量在0.45 mol~0.6 mol之间
D.常温下与足量2mol/LNaOH反应,放出H2的量在0.45 mol~0.6 mol之间