微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)
Ⅰ 浓度为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+)依次为a mol·L-1,b mol·L-1,c mol·L-1,其由大到小的顺序是________。
(2)完全中和一定量NaOH溶液时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为__________________________________。
(3)与锌反应开始时产生氢气的速率分别为v1、v2、v3,其由大到小的顺序是________。
Ⅱ c(H+)相同的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液均加水稀释至体积为原来的10倍, c(H+)依次为a mol·L-1,b mol·L-1,c mol·L-1,其由大到小的顺序是_______。
(2)三种溶液体积相同时,同时加入相同的锌,若产生相同物质的量的氢气,所需时间分别为t1、t2、t3,其大小关系是___________.
参考答案:Ⅰ⑴bac? ⑵V1=2V2=V3? ⑶bac Ⅱ⑴c>a="b" ⑵t1=t2>t3
本题解析:Ⅰ.
(1)盐酸c(H+)=0.1mol/L、硫酸c(H+)=0.2mol/L、醋酸c(H+)<0.1mol/L,故b>a>c。
(2)浓度相同的醋酸,盐酸,硫酸,三者的溶液中H+浓度关系为硫酸>盐酸>醋酸,因为硫酸为二元酸,H+浓度为盐酸电离出H+浓度的2倍,而醋酸为弱酸,部分电离所以H+浓度是最小的,但总的H+的浓度关系为盐酸=醋酸<硫酸,盐酸和硫酸为强酸完全电离,所以中和NaOH所需的酸的体积关系为醋酸=盐酸>硫酸,即V1=2V2=V3。
(3)与锌反应,反应速率与溶液中的H+的浓度有关,H+的浓度关系为硫酸>盐酸>醋酸,所以初始反应速率关系为硫酸>盐酸>醋酸,即v2>v1>v3。
Ⅱ.
(1)三种溶液均加水稀释至体积为原来的10倍, 盐酸、硫酸是强电解质完全电离,所以c(H+)都减小为原来的1/10,醋酸是弱电解质,加水稀释会有部分氢离子又电离处理,所以c(H+)不会减小到原来的1/10。故c(H+) 由大到小的顺序是c>a=b。
(2)三种溶液体积相同时,同时加入相同的锌,若产生相同物质的量的氢气,所需时间由于盐酸、硫酸c(H+)相等。所以t1=t2。醋酸是弱电解质,只有部分氢离子电离出来。随着反应的进行,会继续电离出氢离子。所以醋酸c(H+)会比盐酸、硫酸c(H+)大。故醋酸反应所需时间最短。t1=t2>t3。
点评:本题注意把握醋酸的部分电离对c(H+)的影响。
本题难度:一般
2、选择题 相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应
A.强酸溶液产生较多的氢气
B.两者产生等量的氢气
C.无法比较两者产生氢气的量
D.弱酸溶液产生较多的氢气
参考答案:D
本题解析:强酸完全电离,弱酸部分电离。当二者的体积相同,溶液的pH也相同时,弱酸溶液最终电离产生的H+的物质的量多,所以最终与足量的活泼金属Mg发生反应放出的氢气多。因此选项为D。
本题难度:一般
3、选择题 向醋酸溶液中滴加氢氧化钠溶液,则 (? )
A.醋酸的电离平衡向左移动
B.溶液的PH减小
C.醋酸根离子物质的量减小
D.醋酸的浓度减小
参考答案:D
本题解析:本题是对影响电离平衡的条件以及电离平衡的移动的考查。加入氢氧化钠,会发生H++OH-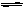 H2O,使CH3COOH
H2O,使CH3COOH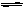 CH3COO-+ H+向左进行,故A错误;虽然平衡向左进行,但是OH-的存在,使H+浓度减小,PH增大,OH-的物质量增多,醋酸浓度减小。故B、C错误,D正确。在解析过程中,往往由于对平衡知识掌握不扎实而错选。
CH3COO-+ H+向左进行,故A错误;虽然平衡向左进行,但是OH-的存在,使H+浓度减小,PH增大,OH-的物质量增多,醋酸浓度减小。故B、C错误,D正确。在解析过程中,往往由于对平衡知识掌握不扎实而错选。
本题难度:简单
4、选择题 下列关于常温下电解质溶液的叙述中,正确的是( )
A.碳酸氢铵溶液和足量的氢氧化钠溶液混合的离子反应:HCO3-+OH-=CO32-+H2O
B.等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-)
C.等物质的量浓度的NH4Cl溶液和NH3?H2O溶液,溶液中c(NH4+)前者小于后者
D.25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c?(OH-)=1×10-8mol?L-1
参考答案:A.该反应离子方程式为:HCO3-+NH4++2OH-=CO32-+NH3.H2O,故A错误;
B.溶液呈电中性,溶液中阴阳离子所带电荷相等,根据电荷守恒得c(H+)+c(NH4+)=c(Cl-)+c(OH-),故B正确;
C.氯化铵是强电解质,完全电离,一水合氨是弱电解质部分电离,所以溶液中c(NH4+)前者大于后者,故C错误;
D.室温下,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c?(OH-)=1×10-6mol?L-1,故D错误;
故选B.
本题解析:
本题难度:简单
5、选择题 下列判断正确的是
A.在水电离出来的c(H+)=1×10-13mol/L的溶液中Fe3+、NH4+、NO一定不能大量共存
B.AlCl3溶液蒸干后得到的固体是AlCl3
C.在0.1 mol/L CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.pH=3的醋酸溶液跟pH=11的氢氧化钡溶液等体积混合后,溶液pH=7
参考答案:C
本题解析:A、该溶液可能为酸性也可能为碱性,在酸性溶液中可以共存;
B、氯化铝在加热过程中,水解程度增大,且生产HCl挥发,故最终得到三氧化二铝;
C、该等式为质子守恒,正确;
D、醋酸为弱酸,混合后醋酸过量,溶液呈酸性。
本题难度:一般