微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: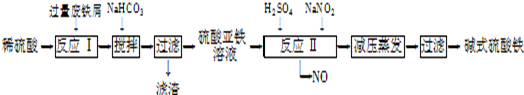
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 3.4
|
完全沉淀
| 3.2
| 9.7
| 4.4
|
回答下列问题:
(1)加入过量废铁屑的目的是?;加入少量NaHCO3的目的是调节pH,使溶液中的??
(填“Fe3+”“Fe2+”或“Al3+”)沉淀,该工艺中“搅拌”的作用是??。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作??,若参与反应的O2有11.2L(标准状况),则相当(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成
Fe2(OH)42+聚合离子.该水解反应的离子方程式为??。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,为检验所得产品中是否含有Fe2+,应使用的试剂为??。(填字母)。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
参考答案:(1)使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+;Al3+;加快反应速率;
(2)氧化剂? 2mol
(3)2Fe(OH)2++2H2O Fe2(OH)42++2H+
Fe2(OH)42++2H+
(4)D
本题解析:(1)由题意可知,过量废铁屑溶于稀硫酸得FeSO4、Al2(SO4)3混合溶液,使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+;根据表中数据可知,向混合溶液中加入少量NaHCO3,沉淀Al3+而不沉淀Fe2+,反应方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,控制pH在4.4~7.5之间;工艺中搅拌作用是加快反应速率。
(2)反应Ⅱ是氧化亚铁离子便于铁离子沉淀分离,流程产物分析可知O2与NaNO2在反应中做氧化剂;n(O2)=11.2L/22.4L/mol==0.5mol,则得到电子0.5mol×4=2mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到2mol电子,NaNO2的物质的量为 2mol.
(3)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2[Fe(OH)]2++2H2O=[Fe2(OH)4]2++2H+.(4)A、氯水可以氧化亚铁离子为铁离子,溶液颜色变化不明显,不能检验亚铁离子,故A不符合;
B、KSCN溶液和亚铁离子不反应,无现象发生,故B不符合;
C、NaOH溶液加入和铁离子反应生成红褐色沉淀不能检验是否存在亚铁离子,故C不符合;
D、酸性KMnO4溶液氧化亚铁离子高锰酸钾溶液褪色,故D符合。
本题难度:一般
2、选择题 要除去FeCl2中含有的Fe3+、Cu2+、H+,应选择的试剂是(?)
A.氯气
B.NaOH
C.铁粉
D.氨水
参考答案:C
本题解析:铁粉可将铁离子还原为亚铁离子、铜离子还原为铜单质、氢离子还原为氢气除去,而自身被氧化为亚铁离子,不会产生新的杂质离子。
本题难度:一般
3、选择题 Cu和Cu2O的混合物7.6 g与足量稀硝酸反应,产生NO气体在标准状况下体积为1.12 L,向所得溶液中加入足量的NaOH溶液,产生的沉淀经过滤、洗涤、干燥、灼烧后,得到黑色固体的质量是
A.8.8 g
B.9.2g
C.8 g
D.16 g
参考答案:A
本题解析:标准状况下体积为1.12 LNO气体的物质的量为0.05mol;反应过程中转移电子的物质的量为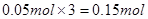 ;设铜的物质的量为x,氧化亚铜的物质的量为y;所以得
;设铜的物质的量为x,氧化亚铜的物质的量为y;所以得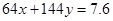 ;
;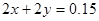 ;解得
;解得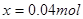 ;
;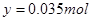 ;由铜元素守恒得最后得到的黑色固体为氧化铜且物质的量为
;由铜元素守恒得最后得到的黑色固体为氧化铜且物质的量为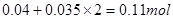 ,所以其质量为8.8 g;
,所以其质量为8.8 g;
本题难度:简单
4、填空题 (16分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2 2SO3,该反应的平衡常数表达式为K=?;过量的SO2与NaOH溶液反应的化学方程式为?。
2SO3,该反应的平衡常数表达式为K=?;过量的SO2与NaOH溶液反应的化学方程式为?。
(2)用36.5%(密度为1.2g·㎝-3)的盐酸的配制500mL的30%(密度为1.095g·㎝-3的盐酸,所需玻璃仪器是?(?)
A.玻璃棒
B.烧杯
C.托盘天平
D.500mL量筒
 溶液吸收,尾气中污染空气的气体为?(写化学式)。
溶液吸收,尾气中污染空气的气体为?(写化学式)。