微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,用蒸馏水逐渐稀释0.1mol·L-1的氨水,下列各数值不会逐渐增大的是
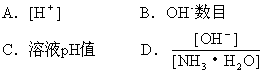
参考答案:C
本题解析:对弱电解质的稀溶液来说,在加水稀释的过程中,电离生成的离子结合成弱电解质的可能性减小,其电离程度增大,电离出的离子个数增多,但由于溶液的体积变化大,离子浓度反而减小。氨水中存在以下电离平衡:NH3+H2O NH4++OH-,H2O
NH4++OH-,H2O H++OH-,由于思维定势,弱碱溶液中仅讨论有关氢氧根离子的量,忽略了氢离子量的讨论。而碱溶液中氢离子浓度增大,似乎酸性增强,选择了A选项。实际上氨水在稀释过程中,氢氧根离子个数增多,氢氧根浓度减小。在酸、碱的稀溶液中,水的离子积不变,因此氢离子浓度增大。但氢离子浓度始终小于氢氧根离子浓度,溶液显碱性,选项A不符合本题题意要求。选项D中的氢氧根离子浓度和氨水的浓度随着氨水稀释过程都减小,但减小的速率不易直观判断。显然随氨水稀释,电离程度增大,比值也增大,因此选项D也不符合本题题意要求。由于氢离子浓度增大,溶液pH只能减小,选项C为本题正确答案。?
H++OH-,由于思维定势,弱碱溶液中仅讨论有关氢氧根离子的量,忽略了氢离子量的讨论。而碱溶液中氢离子浓度增大,似乎酸性增强,选择了A选项。实际上氨水在稀释过程中,氢氧根离子个数增多,氢氧根浓度减小。在酸、碱的稀溶液中,水的离子积不变,因此氢离子浓度增大。但氢离子浓度始终小于氢氧根离子浓度,溶液显碱性,选项A不符合本题题意要求。选项D中的氢氧根离子浓度和氨水的浓度随着氨水稀释过程都减小,但减小的速率不易直观判断。显然随氨水稀释,电离程度增大,比值也增大,因此选项D也不符合本题题意要求。由于氢离子浓度增大,溶液pH只能减小,选项C为本题正确答案。?
本题难度:简单
2、填空题 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号
| 1
| 2
| 3
| 4
|
消耗NaOH溶液的体积(mL)
| 20.05
| 20.00
| 18.50
| 19.95
|
?
则该醋酸溶液的准确浓度为__________(保留小数点后四位)。
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol/L)
| 0.0010
| 0.0100
| 0.0200
| 0.1000
| 0.2000
|
pH
| 3.88
| 3.38
| 3.23
| 2.88
| 2.73
|
?
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
____________________________________________________
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度________(填“增大”、“减小”或“不变”)。
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:____________________________________________
参考答案:(1)胶头滴管 250 mL容量瓶 (2)0.200 0 mol/L
(3)0.010 0 mol/L醋酸的pH大于2(或醋酸稀释10倍时,pH的变化值小于1,合理即可) (4)增大
(5)探究温度对醋酸电离程度的影响
本题解析:(1)配制一定物质的量浓度的溶液时用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和容量瓶。
(2)由于第3次实验的数据差别太大,舍去,则消耗NaOH溶液的体积为: ?mL=20.00 mL,则c(CH3COOH)=0.200 0 mol/L。
?mL=20.00 mL,则c(CH3COOH)=0.200 0 mol/L。
(3)由表中数据知,0.010 0 mol/L醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1,可以得出醋酸是弱电解质。
(4)从表中的数据知,随着醋酸浓度的减小,醋酸的电离程度增大。
(5)用pH计测定相同浓度的醋酸在几种不同温度时的pH的目的是:探究温度对醋酸电离程度的影响。
本题难度:一般
3、简答题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 | HA物质的量浓度
(mol?L-1) | NaOH物质的量浓度
(mol?L-1) | 混合溶液的pH
甲
0.2
0.2
pH=a
乙
c
0.2
pH=7
丙
0.2
0.1
pH>7
丁
0.1
0.1
pH=9
|
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a?(混合溶液的pH)来说明HA是强酸还是弱酸______.
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2______(选填“是”或“否”).混合液中离子浓度c(A-)与?c(Na+)的大小关系是______.
(3)丙组实验结果分析,HA是______酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是______.
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=______mol?L-1.写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)-c(A-)=______mol?L-1?c(OH-)-c(HA)=______mol?L-1.
参考答案:(1)一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度都为0.2mol/L,则酸碱的物质的量相等,如a=7,说明反应后溶液呈中性,则HA是强酸,如a>7,反应后呈碱性,则HA是弱酸,
故答案为:a=7为强酸,a>7为弱酸;
(2)反应后溶液呈中性,如HA为强酸,则c=0.2,如HA为弱酸,则c>0.2,仅从乙组情况分析,c不一定等于0.2,
由于反应后溶液呈中性,则有c(OH-)=c(H+),根据溶液呈中性,则有c(Na+)+c(H+)=c(A-)+c(OH-),
所以c(A-)=c(Na+),故答案为:否;c(A-)=c(Na+);
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸,在溶液中存在A-+H2O?HA+OH-,则
c(Na+)>c(A-),溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为:弱;c(Na+)>c(A-)>c(OH-)>c(H+);
(4)溶液的pH=9,则氢离子浓度为10-9 mol/L,等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH-)=Kwc(H+)=10-1410-9=10-5 mol/L,
一元酸HA和NaOH溶液等体积混合生成NaA溶液,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),
依据上述计算得到:c(Na+)-c(A-)=c(OH-)-c(H+)=10-5-10-9;?
依据溶液中电荷守恒和物料守恒得到:c(Na+)+c(H+)=c(OH-)+c(A-),c(Na+)=c(A-)+c(HA),合并得到c(OH-)-c(HA)=c(H+)=10-9 ,
故答案为:10-5;10-5-10-9;10-9.
本题解析:
本题难度:一般
4、填空题 对于弱酸,在一定温度下达到电离平衡时,各粒子的浓度存在一种定量的关系.若25℃时有HA? H++A-,则K=
H++A-,则K= 式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃).
式中:K为电离平衡常数,只与温度有关,c为各粒子的平衡浓度.下表是几种常见弱酸的电离平衡常数(25℃).

回答下列各题:
(1)K只与温度有关,当温度升高时,K值________(填“增大”、“减小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?________.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是________,最弱的是________.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________,产生此规律的原因是________________________________________.
参考答案:(1)增大
(2)K值越大,电离出的氢离子浓度越大,所以酸性越强
(3)H3PO4 ;HPO42-
(4)K1∶K2∶K3≈1∶10-5∶10-10 ;上一级电离产生的H+对下一级电离有抑制作用
本题解析:
本题难度:一般
5、填空题 硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:
H2SO4=H++HSO4-,HSO4- H++SO42-。
H++SO42-。
请回答下列有关问题:
(1)K2SO4溶液呈 ____________ (填“弱酸性”、“中性”或“弱碱性”),其理由是_____________________________(用离子方程式表示)。
(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为________________________________。
(3)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO42-)="0.029" mol·L-1,则HSO4-的电离常数Ka="____________" (保留两位有效数字);0.10 mol·L-1的H2SO4溶液中c(H+)____________ 0.129mol·L-1(填“>”、“=”或“<”)。
参考答案:
本题解析:(1)由于SO42-+H2O HSO4-+OH-,故K2SO4溶液呈弱碱性;(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为HSO4-+HCO3-=H2O+CO2↑+SO42-;(3)NaHSO4溶液中存在硫酸氢根离子的电离平衡:HSO4-?H++SO42-,其Ka=[H+]?[SO42?]/[HSO4?]=0.029 mol·L-1?0.029 mol·L-1/(0.1-0.029) mol·L-1="0.012" mol·L-1;25℃时,0.10mol?L-1的NaHSO4溶液中c(?SO42-)=0.029mol?L-1,则0.10mol?L-1的H2SO4溶液中氢离子浓度比硫酸氢钠溶液中大,对硫酸氢根离子电离平衡起到抑制作用,c(?SO42-)<0.029mol?L-1。
HSO4-+OH-,故K2SO4溶液呈弱碱性;(2)NaHSO4溶液与NaHCO3溶液反应的离子方程式为HSO4-+HCO3-=H2O+CO2↑+SO42-;(3)NaHSO4溶液中存在硫酸氢根离子的电离平衡:HSO4-?H++SO42-,其Ka=[H+]?[SO42?]/[HSO4?]=0.029 mol·L-1?0.029 mol·L-1/(0.1-0.029) mol·L-1="0.012" mol·L-1;25℃时,0.10mol?L-1的NaHSO4溶液中c(?SO42-)=0.029mol?L-1,则0.10mol?L-1的H2SO4溶液中氢离子浓度比硫酸氢钠溶液中大,对硫酸氢根离子电离平衡起到抑制作用,c(?SO42-)<0.029mol?L-1。
本题难度:一般