微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列数据中,前者一定大于后者的是( )
A.中和pH与体积相同的Ba(OH)2和氨水所消耗0.1moL/L硫酸溶液的体积
B.浓度均为0.1moL/L的(NH4)2CO3溶液和(NH4)2SO4溶液中的c(NH4+)
C.浓度均为0.1moL/L的醋酸溶液和盐酸的pH
D.pH相同的KOH溶液和K2CO3溶液中,水电离出来的c(OH-)
参考答案:A.pH相同的碱,弱碱的浓度大,则中和pH与体积相同的Ba(OH)2和氨水所消耗0.1moL/L硫酸溶液的体积为氨水多,前者小于后者,故A不选;
B.(NH4)2CO3溶液中离子相互促进水解,则浓度均为0.1moL/L的(NH4)2CO3溶液和(NH4)2SO4溶液中的c(NH4+)为前者小于后者,故B不选;
C.因弱酸不完全电离,则浓度均为0.1moL/L的醋酸溶液和盐酸电离出的氢离子浓度为盐酸的大,pH小,即前者大于后者,故C选;
D.pH相同的KOH溶液和K2CO3溶液中,KOH抑制水的电离,K2CO3促进水的电离,水电离出来的c(OH-)后者大,故D不选;
故选C.
本题解析:
本题难度:简单
2、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(红色溶液)  ?H+(溶液)+ In-(黄色溶液)
?H+(溶液)+ In-(黄色溶液)
浓度为0.02 mol·L-1的下列各溶液:?①盐酸②石灰水③NaCl溶液?④NaHSO4溶液?⑤NaHCO3溶液?⑥氨水,⑦AlCl3溶液其中能使指示剂显红色的是
参考答案:C
本题解析:向溶液中加盐酸、硫酸氢钠溶液、氯化铝(水解生成盐酸)溶液c(H+)都增大,平衡向左移动,指示剂显红色;向溶液中加石灰水、碳酸氢钠溶液(水解生成氢氧化钠)、氨水c(OH-)都增大,平衡向右移动,溶液显黄色;溶液中加入氯化钠溶液平衡不移动,溶液显橙色。
点评:硫酸氢钠在水溶液中相当于一元酸。
本题难度:一般
3、填空题 (12分)某研究性学习小组探究醋酸的溶液情况,进行了如下实验。
(1)取一定量的冰醋酸配制250 mL 0.5000 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________和___________。
(2)用上述0.5000 mol·L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对25.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号
| 1
| 2
| 3
| 4
|
消耗NaOH溶液的体积(mL)
| 25.05
| 25.00
| 23.80
| 24.95
|
则该醋酸溶液的浓度为________________。
(3)实验(2)中,滴定过程中pH变化曲线如图所示(室温条件下)。

①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为 。
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9。则混合溶液中:水的电离度是纯水的 倍;
c (OH-) -c (CH3COOH) = mol·L-1。
参考答案:(1)250mL容量瓶(2分,写容量瓶不给分)胶头滴管(2分)(2)0.2000mol·L-1(2分)
(3)①c(CH3COO-)>c(Na+)>c(H+)>c(OH-)(2分) ②100(2分) 10-9(2分)
本题解析:(2)配置一定物质的量浓度的溶液值一定要用到容量瓶,溶液需要250mL,故选用250mL容量瓶来,在定容的时候还要用到胶头滴管。(2)在四组数据中第3组相差太大,要舍去,消耗NaOH溶液的体积为:(22.05+25.00+24.95)÷3="25.00" mol,根据c(NaOH)×V(NaOH)=c(CH3COOH)×V(CH3COOH),0.2000 mol·L-1×25.00 mol= c(CH3COOH)×25.00 mL,得c(CH3COOH)=0.2000mol·L-1。(3)①滴加12.50mLNaOH时CH3COOH没有完全反应,CH3COOH过量,溶液显酸性,离子浓度大小顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。②当滴加25.00mLNaOH时CH3COOH完全反应,生成CH3COONa,CH3COO-水解使得溶液显碱性,pH=9时c(H+)=10-9mol·L-1,则c(OH-)=10-5mol·L-1,此时的OH-都是由水电离出来的,纯水电离的c(OH-)=10-7mol·L-1,是纯水电离程度的100倍。根据电荷守恒和物料守恒有c (OH-) +c (CH3COO-) =c(H+)+ c(Na+),c(Na+)= c(CH3COO-)+ c(CH3COO-),则有c (OH-) -c (CH3COOH)=c(OH-)=10-9mol·L-1
考点:溶液的配制、离子浓度的浓度大小比较和离子浓度的计算。
本题难度:困难
4、填空题 (6分)室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
| 起始浓度/(mol·L-1)
| 反应后溶液的pH
|
c(HA)
| c(KOH)
|
①
| 0.1
| 0.1
| 9
|
②
| x
| 0.2
| 7
|
(1)由实验①写出HA的电离方程式是 。
(2)以下各空均选填“>、<、=”。
实验②反应后的溶液中:c(A-)+c(HA) 0.1mol·L-1
室温下,将pH=3的HA溶液稀释到原体积的10倍后,溶液的pH 4
室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则a b
参考答案:(3)20 mL 0.1 mol/L NaA溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中离子浓度由大到小的顺序是 。(1) HA  H+ +A- (2) > < < (3) c(Na+) >c(A-)>c(Cl-)> c(H+)> c(OH-)
H+ +A- (2) > < < (3) c(Na+) >c(A-)>c(Cl-)> c(H+)> c(OH-)
本题解析:
试题解析:(1)物质的量浓度体积相等HA和氢氧化钾混合,二者恰好反应生成盐,混合溶液呈碱性,说明生成的盐是强碱弱酸盐,则HA是弱酸;(2)KA是强碱弱酸盐,其溶液呈碱性,要使酸碱混合溶液呈中性,则酸应该稍微过量,即酸的物质的量浓度应稍大于0.1mol/L,根据物料守恒可得:c(A-)+c(HA) >0.1mol·L-1;室温下,将pH=3的HA溶液进行稀释,稀释过程中,HA的电离平衡向正向移动,削弱氢离子浓度的减小程度,则稀释到原体积的10倍后,氢离子浓度大于原浓度的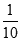 ,PH<4;室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则盐酸与氢氧化钠恰好完全中和,HA稍微过量,但因为HCl是强电解质,完全电离,HA是弱电解质,微弱电离,盐酸中氢离子浓度大于HA,a室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性a<b。(3)20 mL 0.1 mol/L NaA溶液与10 mL 0.1 mol/L HCl溶液混合后,得到等浓度的NaA、NaCl和HA的混合溶液,溶液呈酸性,溶液呈酸性,则NaA的水解程度小于HA的电离程度,故所得溶液中离子浓度由大到小的顺序是:c(Na+) >c(A-)>c(Cl-)> c(H+)> c(OH-)。
,PH<4;室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性,则盐酸与氢氧化钠恰好完全中和,HA稍微过量,但因为HCl是强电解质,完全电离,HA是弱电解质,微弱电离,盐酸中氢离子浓度大于HA,a室温时,向等体积pH=a的盐酸和pH=b的HA溶液中分别加入等量的氢氧化钠后,两溶液均呈中性a<b。(3)20 mL 0.1 mol/L NaA溶液与10 mL 0.1 mol/L HCl溶液混合后,得到等浓度的NaA、NaCl和HA的混合溶液,溶液呈酸性,溶液呈酸性,则NaA的水解程度小于HA的电离程度,故所得溶液中离子浓度由大到小的顺序是:c(Na+) >c(A-)>c(Cl-)> c(H+)> c(OH-)。
考点:弱电解质的电离、盐类水解
本题难度:困难
5、选择题 下列有关说法正确的是
A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0
B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反
C.加热0.1mol·L-1FeCl3溶液,Fe3+的水解程度增大、溶液的pH减小
D.向0.1mol·L-1CH3COOH溶液中加水,则c(H+)与c(CH3COOH)的比值减小