微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将0.1mol/LHF溶液不断加水稀释,下列分析与结论对应正确的是
[? ]
分析
结论
A.
弱酸稀释时,电离平衡正向移动,溶液中n(H+)增大,pH也增大
错误
B.
温度不变,电离程度、Ka均不变?
正确
C.
在同一溶液中,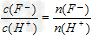 ,随溶液的稀释,弱酸对水的电离的
,随溶液的稀释,弱酸对水的电离的
抑制作用减弱,水电离出的H+逐渐增多,所以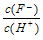 逐渐减小?
逐渐减小?
错误
D.
在同一溶液中,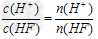 ,随溶液的稀释,HF的电离平衡正
,随溶液的稀释,HF的电离平衡正
向移动, n(H+)增大,n(HF)减小,所以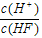 始终保持增大
始终保持增大
正确
参考答案:D
本题解析:
本题难度:一般
2、选择题 一定温度下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中c(OH—)
之比为
A.大于10
B.小于10
C.等于10
D.无法确定
参考答案:B
本题解析:弱电解质溶液中,弱电解质的浓度越大,其电离程度越小,浓度越小,其电离程度越大,据此可以判断。一水合氨是弱电解质,在溶液里存在电离平衡,氨水的浓度越大,一水合氨的电离程度越小,浓度越小,一水合氨的电离程度越大。甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,由弱电解质的浓度越小,电离程度越大可知,甲瓶氨水的电离程度比乙瓶氨水的电离程度小,所以甲、乙两瓶氨水中c(OH—)之比小于10,答案选B。
本题难度:一般
3、选择题 下列说法正确的是
A.在气体反应中,升高温度和增大压强都能使单位体积内的反应物中活化分子数和活化分子百分数同时增大
B.pH等于7的溶液一定呈中性
C.c(H+)=c(OH-)的溶液一定呈中性
D.在0.1mol/L的醋酸溶液中,加入少量水平衡向右移,电离平衡常数增大
参考答案:C
本题解析:A错,升高温度,能使单位体积内的反应物中活化分子百分数增大;增大压强,能使单位体积内的反应物中活化分子数增多;
B错,pH等于7的溶液不一定呈中性,如当温度为100℃时,pH=6为中性,而pH=7为碱性。
C正确,任何溶液中,c(H+)=c(OH-)的溶液一定呈中性;
D错,在0.1mol/L的醋酸溶液中,加入少量水平衡向右移,越稀越易电离,电离程度越大,但电离平衡常数不变,电离平衡常数只受温度影响而影响。
本题难度:一般
4、选择题 醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验研究”的探究活动。他设计了如下方案,其中错误的是
[? ]
A.先配制一定量的0. 10mol/L的CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸是弱电解质
B.先配制一定量0. 01mol/L和0.1mol/L的CH3COOH溶液,分别用pH计测它们的pH,若两者pH相差小于1个单位,则可证明醋酸是弱电解质
C.先测0.10mol/L CH3COOH溶液的pH,然后将其加热至100℃,再测pH,如果pH变小,则可证明醋酸是弱电解质
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质
参考答案:C
本题解析:
本题难度:一般
5、选择题 在室温下,0.1 mol·L-1 100ml的氨水中,欲使其溶液的pH减小,又要使氨水电离程度减小,应采取(? )
A.通入少量氯化氢气体
B.加入少量水
C.加入少量NaOH固体
D.加入少量NH4Cl固体
参考答案:D
本题解析:略
本题难度:简单