微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 足量的Fe粉与一定量的盐酸反应,为了减慢反应速率,但又不影响产生氢气的总量,应加入下列物质中的( )
A.NaNO3溶液
B.NaCl固体
C.Na2SO4溶液
D.CuSO4粉末
参考答案:根据发生的反应为Fe+2H+═Fe2++H2↑,则减小氢离子的浓度而不改变氢离子的物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,
A、加入NaNO3溶液,Fe与硝酸根离子、氢离子发生氧化还原反应生成NO,而不生成氢气,故A错误;
B、加入NaCl固体,对反应无影响,不会减慢反应速率,故B错误;
C、加入Na2SO4溶液,硫酸钠不参与反应,溶液体积变大,则氢离子的浓度减小,但氢离子的物质的量没有变化,则反应速率减慢,但又不影响产生氢气的总量,故C正确;
D、加入CuSO4,构成Fe、Cu、盐酸原电池,加快反应速率,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 100毫升2摩/升H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速度,但又不影响生成氢气的总量.可向反应物中加入适量的
A.碳酸钠(固体)
B.硝酸钾溶液
C.硫酸钾溶液
D.硫酸铵(固体)
参考答案:C
本题解析:碳酸钠能和稀硫酸反应放出CO2气体,消耗氢离子,降低氢离子的浓度,反应速率降低,但生成的氢气体积减少,A不正确;B中在酸性条件下,硝酸钾具有强氧化性,和锌反应得不到氢气,B不正确;硫酸钾溶液相当于是稀释,氢离子浓度降低,反应速率降低,且生成的氢气体积不变,C正确;硫酸铵固体不能降低氢离子的浓度,所以不能改变反应速率,D不正确,答案选C。
点评:该题是基础性试题的考查,主要是考查学生对外界条件影响反应速率的熟悉了解程度,有利于培养学生的逻辑推理能力,提高学生的应试能力和学习效率。该题的易错点是选项B,需要注意在酸性条件下NO3-的氧化性。
本题难度:一般
3、选择题 如下图所示a曲线表示一定条件下可逆反应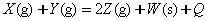 的反应过程。若使a曲线变成b曲线,可采取的措施是(?)。
的反应过程。若使a曲线变成b曲线,可采取的措施是(?)。
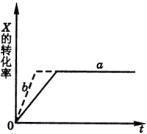
A.加入催化剂
B.增加Y的浓度
C.降低温度
D.增大体系压强
参考答案:A、D
本题解析:改变条件后a曲线与b曲线中X的转化率仍相等,说明平衡没有移动。这是一个反应前后分子数相等的反应,因此催化剂与压强不能使平衡移动。
本题难度:一般
4、填空题 (10分)臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是 和 (填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
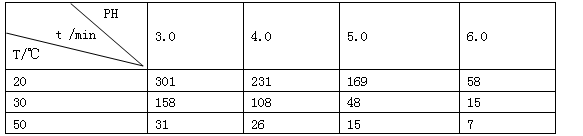
①pH增大能加速O3分解,表明对O3分解起催化作用的是 。
②在30℃、pH=4.0条件下,O3的分解速率为 。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为 (填字母代号)。
A.40 ℃、pH=3.0 B.10 ℃、pH=4.0 C.30 ℃、pH=7.0
参考答案:(1)O2、I2;
(2)①OH-;②1.00×10-4mol/(L·min);
③b<a<c;
本题解析:(1)O3与KI溶液反应不可能生成K单质,故生成的两种单质只能为O2、I2。
(2)①由表中数据可知:pH由3.0到6.0增大,O3分解速率加快,则OH-浓度增大,化学反应速率加快,所以表明OH-对O3分解起催化作用;
②在30℃、pH=4.0条件下,O3的分解速率为:v=△c/△t=0.0108mol/L=1.00×10-4mol/(L·min);
③由表中数据可知,40°C、pH=3.0时,所需时间t1:31min<t1<158min之间;10°C、pH=4.0时,所需时间t2>231min;30°C、pH=7.0时,所需时间t3<15min,则分解速率依次增大的顺序为b<a<c;
考点:了解化学反应速率的概念、反应速率的定量表示方法。理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,认识并能用相关理论解释其一般规律。
点评:考查影响速率的因素,培养学生分析利用实验数据的能力。
本题难度:一般
5、实验题 (10分)经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1) 定性分析:如图甲可通过观察____________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________________________________________________________,
写出H2O2在二氧化锰作用下发生反应的化学方程式
____________________________________________________________________。
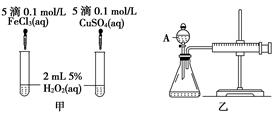
(2) 定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是___________________________________________________________。
检查乙装置气密性的方法是
____________________________________________________________________。
(3) 0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,发生如下反应:
2X(g)+Y(g)===nZ(g)+2W(g), 2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),则前2 min内,用X的物质的量浓度变化表示的平均反应速率为________;2 min末时Y的物质的量浓度为________;化学方程式中,Z的化学计量数n=________。
(4) 在一定温度下,反应:2A(s)+2B(g) 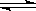 ?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
?C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是________
A.容器内的压强不随时间而变化
B.混合气的密度不再随时间而变化
C.A的质量不再改变
D.平衡混合气体的平均相对分子质量不再改变
参考答案:(1)反应产生气泡快慢;控制阴离子相同,排除阴离子的干扰
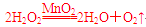
(2)分液漏斗 收集40mL气体所需要的时间 关闭A上的玻璃旋塞,将针筒的活塞拉出(或推进)一段后松开,活塞能回到原来的位置说明气密性良好(其他答案合理也给分)
(3)v(X)=v(W)=0.05 mol·L-1·min-1; 0.25 mol/L;4
(4)A
本题解析:(1)催化剂的不同会引起反应速率的不同,所以根据反应中产生气泡的快慢来定性分析催化剂的催化效果。为了是实验具有可比性,应该使溶液中的阴离子也相同,这样才能排出阴离子不同可能组成的干扰。
(2)从外观分析A是分液漏斗,收集相同的体积,因此需要测量所用时间的长短。由于装置的右侧是带有活塞的针筒,所以检验其气密性时不能利用传统的方法检验,正确的方法是关闭A上的玻璃旋塞,将针筒的活塞拉出(或推进)一段后松开,活塞能回到原来的位置说明气密性良好,否则漏气。
(3)以Z的物质的量浓度变化表示的反应速率为0.1 mol/(L·min),因此生成Z的物质的量是0.1 mol/(L·min)×2L×2min=0.4mol,同时生成W是0.2mol,因为物质的变化量之比是相应的化学计量数之比,所以n等于4.。因为物质的量的变化量和相应的化学计量数是成正比的,所以速率之比应该是相应的化学计量数之比,故用X的物质的量浓度变化表示的平均反应速率也是0.05 mol/(L·min)。生成0.2molW,就必然消耗0.1molY,则剩余Y是0.5mol,所以2 min末时Y的物质的量浓度为0.25mol/L。
(4)因为反应前后气体的体积是不变的,所以在反应过程中压强始终是不变的,A不正确。密度是混合气的质量和容器容积的比值,容积不变,但混合气的质量是变化的,所以当混合气的密度不再随时间而变化时,可以说明达到平衡状态。A的质量不再改变,说明正逆反应速率相等,因此选项C正确。混合气体的平均相对分子质量是混合气的质量和混合气的物质的量的比值,混合气的物质的量不变,但质量是变化的,因此当平衡混合气体的平均相对分子质量不再改变时可以说明已经达到平衡状态。
本题难度:一般