微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 加热N2O5,依次发生的分解反应为①N2O5(g) N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g) N2O(g)+O2(g),在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol·L-1,N2O3的平衡浓度为1.62 mol·L-1,求N2O5和N2O的平衡浓度。
N2O(g)+O2(g),在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol·L-1,N2O3的平衡浓度为1.62 mol·L-1,求N2O5和N2O的平衡浓度。
2、选择题 下列说法不正确的是( )
A.MnO2能加速H2O2的分解,是因为MnO2可以降低反应所需的活化能
B.向橙色的K2Cr2O7溶液中滴加NaOH溶液,溶液颜色变黄,说明化学平衡发生了移动
C.将NO2和N2O4混合气体的平衡体系加压,容器内气体颜色变深,这一事实不能用勒夏特列原理解释
D.在密闭容器中,对于反应2A(g)+B(g) 2C(g),增大压强后,平衡混合气的平均相对分子质量减小
2C(g),增大压强后,平衡混合气的平均相对分子质量减小
3、选择题 利用原料气在合成塔中合成NH3,为加快正反应速率,且提高N2的转化率所采取的措施是?(?)。
A.加压
B.移走氨气
C.使用催化剂
D.充入N2
4、填空题 现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途。
⑴已知:2C(s)+O2(g)=2CO(g);ΔH1 ,? 2H2(g)+O2(g)=2H2O(g);ΔH2 。
则反应C(s)+H2O(g)  CO(g)+H2(g);ΔH=?▲?。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH=?▲?。(用含ΔH1、ΔH2的代数式表示)
⑵CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol?CO和2mol?H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol?CO和2mol?H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
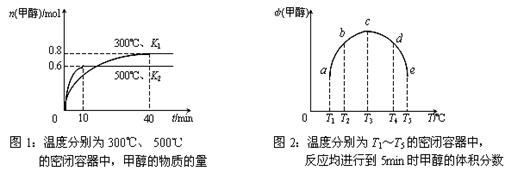
①该反应的ΔH3??▲ ?0(选填“<”、“>”或“=”,下同),K1?▲?K2。
②将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有?▲?。
⑶某燃料电池以CO为燃料,以空气为氧化剂,以熔融态K2CO3为电解质。写出该燃料电池负极的电极反应式:?▲?。
5、选择题 下列图示与对应的叙述相符的是
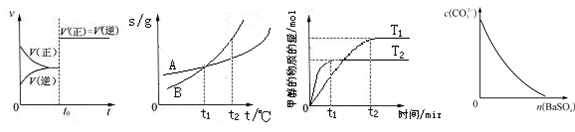
图6?图7?图8?图9
A.图6表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是加入催化剂,也可能是改变压强
B.图7表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图8表示在其他条件相同时,分别在T1、T2温度下由CO2和H2合成甲醇的物质的量随时间变化情况,则CO2和H2合成甲醇是吸热反应
D.图9表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化