微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化合物中,既能由单质直接化合制得,又能由复分解反应制得的是(?)
A.CuS
B.FeS
C.Al2S3
D.FeCl2
参考答案:B
本题解析:硫和铜反应只能生成Cu2S,氯气和铁只能生成FeCl3,Al2S3 可以直接化合,但由于遇水发生双水解 不可在溶液中由复分解制得。?
点评:本题主要考查铁、铜、硫、铝、氯气、等物质的化学性质,只有熟练掌握化学性质才能解答好本题
本题难度:简单
2、实验题 (9分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
①量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液。
②用标准液滴定至终点,记录滴定管液面读数,所得数据如下表:
滴定次数
| 盐酸 体积 体积
| NaOH溶液体积读数(mL)
|
滴定前
| 滴定后
|
1
| 20.00
| 0.00
| 18.10
|
2
| 20.00
| 0.00
| 16.30
|
3
| 20.00
| 0.00
| 16.22
|
请回答下列问题:
(1)步骤①中,量取20.00mL待测液应使用________________(填仪器名称),若在锥形瓶装液前残留少量蒸馏水,将使测定结果_______________(填“偏大”、“偏小”或“无影响”)。
(2)步骤②中,滴定时眼睛应注视________________(填仪器名称),判断到达滴定终点的依据是___________________________________________。
(3)第一次滴定记录的NaOH溶液的体积明显多于后两次的体积,其可能的原因是_______________________(填字母)
A.滴定前滴定管尖嘴有气泡,滴定结束时无气泡
B.锥形瓶装液前用待测液润洗
C.NaOH标准液保存时间过长,有部分Na2CO3生成
D.滴定终点时,俯视读数
(4)根据上表记录数据,通过计算可得该盐酸的浓度为______? mol·L-1?。
参考答案:(9分)
(1)酸式滴定管(1分);无影响(1分)
(2)锥形瓶 (1分)锥形瓶中溶液由无色变为浅红色,且半分钟内不变色(2分)
(1分)锥形瓶中溶液由无色变为浅红色,且半分钟内不变色(2分)
(3)AB(2分)
(4)0.1626(2分)
本题解析:略
本题难度:简单
3、实验题 (17分)甲学生急需3.0 mol·L-1稀硫酸做探究性实验,而此时实验室只有18.4 mol·L-1浓硫酸。请你为他配制100 mL 3.0 mol·L-1稀硫酸。
(1)建议配制过程如下:
①计算所需浓硫酸的体积是?(准确到小数点后一位),量取浓硫酸所用的量筒的规格是?(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
②稀释。具体操作过程是?。
③待上步得到的稀释液充分冷却后,借助玻璃棒引流,注入?。用蒸馏水洗涤烧杯内壁和玻璃棒2-3次,洗涤液也注入其中。轻轻摇动容量瓶,使溶液混合均匀。
④将蒸馏水注入容量瓶,待液面离容量瓶刻度线1-2cm,改用?加水至液面与刻度线相切。盖好瓶塞,反复上下颠倒、摇匀。
⑤将配好的溶液转移到试剂瓶中,交甲同学使用。
(2)在配制溶液过程中,遇到下列情况时,实际浓度会怎样?(填偏高、偏低或不影响)
A.所用的浓硫酸长时间放置在密封不好的容器中?
B.容量瓶用蒸馏水洗涤后残留有少量的水?
C.所用过的烧杯、玻璃棒未洗涤??
D.定容时俯视刻度线??
参考答案:16.3mL? B或25mL(1分,其它每空2分)?沿装有水的烧杯内壁缓缓注入浓硫酸,边加边搅拌? 100mL容量瓶?胶头滴管?偏低?不影响?偏低?偏高
本题解析:(1)1、设浓硫酸的体积为V,18.4mol/L×V=0.1L×3.0mol/L,V=0.0163L=16.3mL;选取量筒的容积应稍大于或等于量取溶液的体积,故选B。
故答案为:16.3ml;B;
然后将浓硫酸沿烧杯内壁缓慢倒入烧杯中,并用玻璃棒搅拌,防止液体飞溅,
故答案为:沿装有水的烧杯内壁缓缓注入浓硫酸,边加边搅拌;
3、洗涤液要转移到100mL容量瓶中,故答案为:100mL容量瓶;
4、将蒸馏水注入容量瓶,待液面离容量瓶刻度线1-2cm,改用 胶头滴管加水至液面与刻度线相切.盖好瓶塞,反复上下颠倒、摇匀。
故答案为:胶头滴管;
(2)A.所用的浓硫酸长时间放置在密封不好的容器中,浓硫酸有吸水性,导致溶质的物质的量偏小,配制溶液的浓度偏低;
B.容量瓶用蒸馏洗涤后残留有少量的水,不影响溶质的物质的量和溶液的体积,所以配制溶液的物质的量浓度无影响。
C.所用过的烧杯、玻璃棒未洗涤,导致溶质的物质的量偏小,配制的溶液浓度偏低;
D.定容时俯视溶液的液凹面,导致溶液的体积偏小,所以配制溶液的浓度偏高。
故答案为:偏低;无影响;偏低;偏高.
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,会根据量取浓硫酸的体积选择量筒
本题难度:一般
4、实验题 (本题共10分)
亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在通常条件下反应得到(NO2与Cl2反应可得硝酰氯)。亚硝酰氯的熔点为-64.5 ℃,沸点为-5.5 ℃,并且遇水蒸气分解为氮的氧化物和氯化氢。
某校化学兴趣小组按如下流程制备亚硝酰氯,实验时,先通入Cl2,待E中U形管内充满黄绿色气体时,再缓缓通入NO。“→”表示气流方向。

34.实验室用氯酸钾和浓盐酸制备Cl2的化学方程式是______________________________。
35.装置F的作用是___________________________________。
36.亚硝酰氯与水反应的化学方程式是________________________________。
37.实验中“先通入Cl2,待E中U形管内充满黄绿色气体时,再将NO缓缓通入”,此操作的目的是______________________________________________________________。
参考答案:
34. KClO3(固体)+6HCl(浓)→KCl+3Cl2↑+3H2O?(2分)
35. 防止G中水蒸气进入U形管,避免引起NOCl水解。(2分)
36. 2NOCl+H2O → N2O3+2HCl? (或2NOCl+H2O → NO+NO2+2HCl) (2分)
37. 防止NO被装置中的氧气氧化为NO2;(1分)保持Cl2过量,使NO完全转化,避免
NO逸出污染空气(3分)
本题解析:34.氯元素的归中反应;35. NOCl易与水反应,装置F可以防止尾气吸收装置G的水蒸气进入;36. NOCl中氮元素化合价为+3价,水解化合价不变,生成N2O3(或1:1的NO和NO2);37.装置中空气中氧气与NO反应生成NO2,进而产生杂质硝酰氯;反应中过量的Cl2,使NO完全转化,避免
NO逸出污染空气。
本题难度:一般
5、实验题 (15分)某兴趣小组同学共同设置了如图所示的实验装置,既可用于制取气体,
又可用于验证物质的性质。
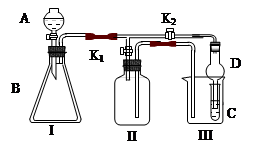
(1)利用I、II装置制取气体(K2闭,K1打开)甲同学认为:利用II装置可以收集H2、NH3等气体,但不能收集O2和NO 等气体,其理由是:__________________________________
____________________________________________________________________
乙同学认为:利用II装置作简单改进,(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是_______________________,利用II装置再作简单改进(不改变仪器装置),还可收集NO2气体,改进方法___________________________。
(2)利用I、III装置验证物质的性质(K2打开,K1关闭),如设计证明氧化性:KMnO4>Cl2>Br2,则在A中加浓盐酸,B中加___________,C中加_________,观察到C中的现象是_________________?_?。
(3) 请利用I、III 装置自行设计有机实验,写出实验所用的试剂,简述C中的实验现象及根据此现象所得结论。
A中加___________,B中加___________,C中加____________
现象:____________________,结论:_________________________________________。
参考答案:(1) 氧气的密度比空气大,NO与空气的密度相差不大,同时NO与氧气反应;
将II装置加满水;?将II装置中加难挥发的有机溶剂。?
(2) KMnO4固体;NaBr 溶液;溶液呈橙色。?
(3) A-水或饱和食盐水;B-电石;C-溴水或酸性高锰酸钾溶液;溴水或酸性高锰酸钾溶液褪色;乙炔为不饱和的化合物。? (或A-盐酸;B-大理石;C-苯酚钠溶液;变浑浊;酸性HCl>H2CO3>C6H5OH )
本题解析:(1)根据装置图可知,该装置适用于收集密度小于空气的,且与空气不反应的气体。由于氧气的密度比空气大,NO与空气的密度相差不大,同时NO与氧气反应,所以不能用该装置收集氧气和NO。要在不改变装置的前提下收集氧气和NO2,则将II装置加满水即可。由于NO2能和水反应,因此要收集NO2,只需要将水换成难挥发的有机溶剂即可。
(2)酸性高锰酸钾溶液能氧化浓盐酸生成氯气,所以在B中加入高锰酸钾固体即可。氯气能置换出单质溴,所以在C中放溴化钠溶液即可,溴水显橙色,所以通入氯气后C中溶液显橙色。
(3)根据装置特点可知,可以验证乙酸、碳酸和苯酚的酸性强弱,或者验证乙炔的化学性质。
本题难度:一般