|
高中化学知识点讲解《气体的净化、干燥、吸收与收集》高频考点强化练习(2017年最新版)(四)
2017-08-26 00:47:29
来源:91考试网
作者:www.91exam.org 【 大 中 小】
 (2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。 (2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
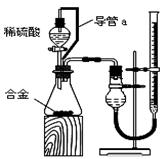
 ①装置中导管a的作用是?。 ①装置中导管a的作用是?。
 ②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。 ②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。   
参考答案:(每空2分,共16分) [方案一 [方案一 ]〖实验方案〗? 2Al+2NaOH+2H2O=2NaAlO2+3H2↑? ]〖实验方案〗? 2Al+2NaOH+2H2O=2NaAlO2+3H2↑?
(1)? 97mL?(2)?偏高?
[方案二](1)①? edg?
②?锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大?③? ACD?
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。?②? V1-V2
本题解析:[方案一]由于镁和氢氧化钠不反应,而铝是反应的,所以反应的方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑;合金中铝的质量最多是5.4g×0.97,则物质的量的是0.2mol×0.97,因此需要氢氧化钠是0.2mol×0.97,所以氢氧化钠溶液溶液的体积至少是97mol;由于固体会吸附某些离子,所以固体的质量会增加,则镁的质量分数将偏高。
[方案二](1)①由于通过排水法测量气体的体积,因此不需要干燥气体,所以最简易的装置其连接顺序是aedg。
②稀硫酸不能滴下,说明容器内压强大于大气压,这是由于锌和稀硫酸的反应是放热反应,且生成氢气,导致压强增大,液体不能滴下。
③读数时必需保证容器内外压强是相同的,所以选项ACD正确,答案选ACD。
(2)①为了使稀硫酸顺利滴下,且消除由于加入稀硫酸引起的氢气体积误差,所以其作用是使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。
②碱式滴定管中液面的前后差值就是生成的氢气体积,所以氢气的体积是 V1-V2ml。
本题难度:一般
2、实验题 二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。某研究小组设计如图所示实验制备ClO2。
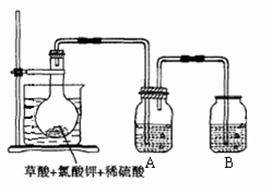
(1)如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为:?,氧化产物与还原产物的物质的量之比为 ?。
(2)控制水浴温度在60~80℃之间的目的是?,图示装置中缺少的一种必须的玻璃仪器是?。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放?。(填序号)
①60 ℃的温水? ②冰水? ③饱和食盐水?
(4)将二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的化学方程式?。
参考答案:(1)2KClO3+H2C2O4+2H2SO4 2ClO2↑+2CO2↑+2KHSO4+2H2O,1︰1。 2ClO2↑+2CO2↑+2KHSO4+2H2O,1︰1。
(2)使反应正常进行,并防止温度过高引起爆炸。温度计。(3)②
(4)5H2S+8ClO2+4H2O=5SO42—+8Cl—+18H+
本题解析:(1)根据提示可知反应的方程式为2KClO3+H2C2O4+2H2SO4 2ClO2↑+2CO2↑+2KHSO4+2H2O。氧化产物和还原产物的物质的量之比为1:1。 2ClO2↑+2CO2↑+2KHSO4+2H2O。氧化产物和还原产物的物质的量之比为1:1。
(2)如果温度过高,会引起爆炸,缺少的必要玻璃仪器是温度计。
(3)因为二氧化氯水溶液温度过高会引起爆炸,所以应该用冰水来吸收。
(4)根据提示可知该反应的方程式为:5H2S+8ClO2+4H2O=5SO42-+8Cl-+18H+。
点评:本题主要考查学生获得信息的能力和实验分析能力。
本题难度:一般
3、选择题 下列气体中,能用排水法收集的是( )
A.H2
B.HCl
C.NO2
D.Cl2
参考答案:A、H2不易溶于水、也不能与水反应,所以能用排水法,故A正确;
B、HCl易溶于水,所以不能用排水法,故B错误;
C、NO2能与水反应,所以不能用排水法收集,故C错误;
D、C12易溶于水、也能与水反应,所以不能用排水法,故D正确;
故选A.
本题解析:
本题难度:简单
4、实验题 (1)题每空1分,(1)题3分,其余各2分,共15分)
某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供如下药品:①2%NaOH溶液②稀HCl③稀H2SO4④饱和KHCO3溶液⑤浓H2SO4⑥CaCO3固体⑦K2CO3粉末⑧纯水。提供如下仪器装置:

请根据题目要求回答下列问题:
(l)请按下表要求,填写选择的装置和药品
?分项
内容
| CO2发生装置(X)
随开随用,随关随停
| 除杂洗气装置(Y)
| 制备产品装置(Z)
| 选择的装置(填序号)
| ?
| ?
| C
| 选择的药品(填序号)
| ?
| ?
| ①
|
(2)如何检验所选择的 发生装置(X)的气密性,请写出主要操作过程: 发生装置(X)的气密性,请写出主要操作过程:
_____________________________________________________________________________
__________________________________________________________________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________,Y装置中除去的杂质为_____________,
(4)常温下,向Z装置的NaOH溶液中通入过量 气体,其原因是_________________;通入过量 气体,其原因是_________________;通入过量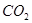 后,Z装置内的溶液中离子浓度大小顺序为:_______________________?。 后,Z装置内的溶液中离子浓度大小顺序为:_______________________?。
参考答案:((1)题每空1分,(1)题3分,其余各2分,共15分)
(1)
选择的装置(填序号)
f
b
?
选择的药品(填序号)
②⑥
④
?
(2)方案1:塞紧单孔塞,(1分)关闭开关,(1分)将烧杯中加入一定量水使干燥管下端管口浸没在水中(1分),如果干燥管内外液面有一定高度差,说明装置的气密性良好(1分)。
方案2:塞紧单孔塞,关闭开关,将烧杯中加入一定量水使干燥管下端管口浸没在水中,如果用手捂住干燥管,管口处出现少量气泡,松手后,干燥管下端管口处出现一段水柱,说明装置的气密性良好(其他方案合理均给分)。 (4分)
(3) (或氯化氢) (或氯化氢)
(4)使溶液中的NaOH完全转化为 ? ?
 ? ?

  
本题解析:(1)要满足随开随用,随关随停免责应该选择f装置,试剂应该是块状的大理石和盐酸。生成的CO2中混有氯化氢,应该用饱和的碳酸氢钾溶液除去氯化氢,装置选择b即可。
(2)考查装置气密性检验的方法。
(3)碳酸钙和盐酸反应生成氯化钙、CO2和水,方程式为 。 。
(4)如果CO2不足,则溶液中会有碳酸钠,所以过量的CO2能使溶液中的NaOH完全转化为 。碳酸氢钠的水解程度电离大于电离程度,溶液显碱性,所以离子浓度大小顺序是 。碳酸氢钠的水解程度电离大于电离程度,溶液显碱性,所以离子浓度大小顺序是 。 。
本题难度:一般
5、实验题 (18分)某化学兴趣小组的同学利用下图所示实验装置进行实验。(图中a、b、c表示止水夹)。
 
请按要求填空:
(1)利用B装置可制取的气体有?(至少填2种),写出实验室里利用A装置制取氯气的离子方程式?。
(2)只用A、C、E相连后的装置用于制取Cl2并进行相关的性质实验。若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
实验序号
| 实验操作
| 现?象
| 结?论
| Ⅰ
| 将氯水滴入品红溶液
| 溶液褪色
| 氯气与水反应的产物有漂白性
| Ⅱ
| 氯水中加入 NaHCO3粉末
| 有无色气泡产生
| 氯气与水反应的产物具有较强的酸性
|
?
①请评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。 (任选1个实验进行评价。)?
?
②若要利用上述A、C装置设计一个简单的实验,验证Cl2和I2的氧化性强弱,可以在甲、乙、丙中分别装入浓盐酸、MnO2、淀粉碘化钾溶液,根据丙中产生的现象是?,则可证明Cl2的氧化性强于I2 。
(3)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式?。
② 欲用D装置验证NO2与水的反应,其操作步骤:先关闭止水夹?(填写a、b或c),再打开止水夹?(填写a、b或c),若要使D烧杯中的水进入试管丁的操作是:通过?试管丁,使试管丁的NO2气体逸出,NO2与水接触后即可引发烧杯中的水倒流进入试管丁。
参考答案:⑴ ?H2、CO2、H2S等(2分) MnO2+2Cl -+4H+  Mn2++Cl2↑+2H2O(2分) Mn2++Cl2↑+2H2O(2分)
⑵ ①实验Ⅰ结论不合理(2分),因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白…(2分);或者实验Ⅱ结论不合理……(2分),因为制取的氯气中含有HCl气体,HCl溶于水后能与NaHCO3粉末反应产生气泡……(2分)?②试管中溶液由无色变为蓝色………(2分)
⑶①? Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O ?………(2分)
②a 、b ……(2分); ?c ……(2分)?双手紧握(或微热)………(2分)
本题解析:(1)该装置的最大特点是可以控制反应的发生和停止,药品一般是固体和液体在常温下能反应,且不需要加热。例如实验室用锌和稀硫酸制取氢气,Zn+H2SO4=ZnSO4+H2↑,锌难溶于水,氢气难溶于水,当将装置中的导气管关闭后,生成的H2使装置中的气压增大,从而使固体和液体分离,使反应停止,所以能用图中的装置制取氢气;与此类似的该装置还可以制备CO2、H2S等;实验室利用二氧化锰氧化浓盐酸制备氯气,反应的离子方程式为MnO2+2Cl -+4H+  Mn2++Cl2↑+2H2O。 Mn2++Cl2↑+2H2O。
(2)①实验室制得的氯气中有杂质气体水蒸气和氯化氢气体,要进行干燥的氯气不具备漂白性的验证试验,再进行实验Ⅰ才能得到结论;氯化氢气体溶于水形成盐酸,盐酸也能和碳酸氢钠反应产生二氧化碳气体,不一定是氯气与水反应的产物的酸性;
②验证Cl-和Br-的还原性强弱可根据反应Cl2+2Br-=2Cl-+Br2设计实验,在A装置中制备氯气,生成的气体通入到装有溴化钠溶液的C中,如烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,可证明氯气的氧化性强于溴;
(3)①浓硝酸具有强氧化性,与铜反应生成二氧化氮气体,反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;
②浓硝酸与铜反应生成的二氧化氮收集于试管丁中,由于二氧化氮能和水反应,则烧杯内气体的压强会减小,小于外界大气压,烧杯中的溶液会倒流于试管丁,所以要先关闭止水夹a、b,然后再打开止水夹c,用微热法使试管中气体逸出,NO2与水接触后即可引发烧杯中的水倒流入试管丁中,从而验证NO2与水的反应。
本题难度:困难
|  (2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
 ①装置中导管a的作用是?。
①装置中导管a的作用是?。 ②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。



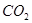 发生装置(X)的气密性,请写出主要操作过程:
发生装置(X)的气密性,请写出主要操作过程: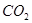 气体,其原因是_________________;通入过量
气体,其原因是_________________;通入过量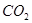 后,Z装置内的溶液中离子浓度大小顺序为:_______________________?。
后,Z装置内的溶液中离子浓度大小顺序为:_______________________?。