微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中,离子浓度的关系一定正确的是
A.氨水中逐滴加入盐酸得到酸性溶液:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.pH相同的CH3COONa溶液、Ba(OH)2溶液、KHCO3溶液:c(K+)>c(Na+)>c(Ba2+)
C.物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
D.将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4)
参考答案:C
本题解析:A、氨水中逐滴加入盐酸得到酸性溶液可能为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),也可能为:c(Cl-)>c(H+)>c(NH4+)>c(OH-),错误;B、pH相同的CH3COONa溶液、Ba(OH)2溶液、KHCO3溶液:c(Na+)>c(K+)>c(Ba2+),错误;C、物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合,因为CO32?的水解程度大于HCO3?的水解程度,所以? c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),正确;D、根据物料守恒,将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),错误。
本题难度:一般
2、选择题 .下列叙述正确的是
A.浓度均为0.2mol·L-1的NH4Cl溶液与NaOH溶液混合,混合液中:
c(NH4+)>c(Cl-)>c(Na+)>c(0H-)>c(H+)
B.仅含有Na+、H+、OH-、CH3C00一四种离子的某溶液中可能存在:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.pH=2的醋酸与pH=12的氢氧化钠等体积混合后,混合液中:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.将pH=8.5的氨水加水稀释后,溶液中所有离子的浓度均降低
参考答案:B
本题解析:A项NH4Cl与NaOH溶液的体积未给,不能确定量的关系,而且该选项根据电荷守恒知,溶液带正电,错;B项根据电荷守恒判断可能存在c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
,正确;C项pH=2的醋酸与pH=12的氢氧化钠等体积混合,醋酸剩余,溶液显酸性,错;D项pH=8.5的氨水加水稀释后,NH4+、OH-浓度下降,H+增大,因为水的离子积不变,错。
本题难度:一般
3、填空题 (12分)镧是重要的稀土元素,应用非常广泛,如应用于压电材料、催化剂等领域。
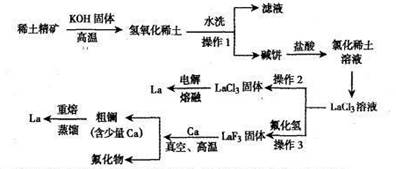
已知:①镧是较活泼金属,在空气中易被氧化;②氢氧化镧是难溶于水的弱碱;
③
金属
| 熔点(℃)
| 沸点(℃)
|
钙
| 841
| 1487
|
镧
| 920
| 3470
|
(1)操作1、3是相同操作,其名称是?。
(2)操作2中要在HCl气体的氛围内加热的原因是?。
(3)电解制镧的尾气要用碱液吸收,请写出反应的离子方程式??。
(4)真空、高温过程中的反应方程式为?。

(5)粗镧精制过程中温度控制范围?。
(6)重熔蒸馏制得的镧中仍然混有及少量的钙。某批次产品69.709g,经分析含钙0.209g,该产品的等级为?(化工产品等级标准:优级纯≥99.8﹪,分析纯≥99.7﹪,化学纯≥99.5﹪).
参考答案:(1)过滤;(2)防止LaCl3水解;(3)Cl2+2OH-=Cl-+ClO-+H2O;
(4)3Ca+2LaF3 3CaF2+2La;(5)1487~3470°C;(6)分析纯
3CaF2+2La;(5)1487~3470°C;(6)分析纯
本题解析:(1)操作1、3是相同操作,都是分离难溶性固体与液体混合物的方法,其名称是过滤。(2)从LaCl3溶液中获得LaCl3固体,由于该盐是强酸弱碱盐,容易发生水解反应,所以为了防止其水解,操作2要在HCl气体的氛围内加热。(3)2LaCl3 2La+ 3Cl2↑.在尾气中含有氯气,要用碱液吸收,该反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O;(4)根据流程图可知:在真空、高温过程中的反应方程式为3Ca+2LaF3
2La+ 3Cl2↑.在尾气中含有氯气,要用碱液吸收,该反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O;(4)根据流程图可知:在真空、高温过程中的反应方程式为3Ca+2LaF3 3CaF2+2La;(5)在粗镧中含有杂质Ca,由于Ca的沸点是1487℃,La的沸点是3470℃,所以精制过程中温度控制范围1487~3470℃;(6)在该产品中La的质量分数是{(69.709g-0.209g)÷69.709g}×100%=99.7﹪,所以属于分析纯。
3CaF2+2La;(5)在粗镧中含有杂质Ca,由于Ca的沸点是1487℃,La的沸点是3470℃,所以精制过程中温度控制范围1487~3470℃;(6)在该产品中La的质量分数是{(69.709g-0.209g)÷69.709g}×100%=99.7﹪,所以属于分析纯。
本题难度:一般
4、填空题 (Ⅰ)化学平衡移动原理,同样也适用于其他平衡
(1)已知在氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O  NH+OH-
NH+OH-
向氨水中加入MgCl2固体时,平衡向 ?移动,OH-的浓度?
向浓氨水中加入少量NaOH固体,平衡向?移动,此时发生的现象是___________。
(2)氯化铁水解的离子方程式为___________________,向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程式为________________,同时有红褐色沉淀生成,其原因是?
(3)向Mg(OH)2的悬浊液中加入NH4Cl溶液,现象?,原
因为?
(Ⅱ)某二元酸 H2A 的电离方程式是:H2A=H++HA,HA- A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)H2A是?(填“强电解质”或“弱电解质”或“非电解质”)
(2)Na2A 溶液显?(填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示)?;
(3)NaHA 溶液显?(填“酸性”、“碱性”或“中性”),理由是(用离子方程式表示)?;
(4)若 0.1mol·L-1NaHA 溶液的 pH=2,则 0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能? 0.11mol·L(填“<”、“>”或“=”),理由是:?;
(5)0.1mol·L NaHA溶液中各离子浓度由大到小的顺序是?。
参考答案:(Ⅰ)(1)右?减小?左?有刺激性气体产生?
(2)Fe3+? + 3H2O Fe(OH)3? + 3H+ ?、 CaCO3 + 2H+===?Ca2+ + H2O +CO2↑?
Fe(OH)3? + 3H+ ?、 CaCO3 + 2H+===?Ca2+ + H2O +CO2↑?
碳酸钙消耗H+ ,促进氯化铁的水解,使水解产物Fe(OH)3大量生成,形成红褐色沉淀
(3)浊液逐渐溶解 溶液中存在平衡 Mg(OH)2 (S)  ?Mg2+(aq)+2OH-(aq) ,加入NH4Cl溶液会发生OH-+NH4+=NH3·H2O?,导致平衡向溶解方向移动,故悬浊液逐渐溶解
?Mg2+(aq)+2OH-(aq) ,加入NH4Cl溶液会发生OH-+NH4+=NH3·H2O?,导致平衡向溶解方向移动,故悬浊液逐渐溶解
(Ⅱ)(1)强电解质?
(2)碱性? A2-+H2O HA-+OH-?
HA-+OH-?
(3)酸性? HA— H++ A2—
H++ A2—
(4)<?因H2A第1步电离产生的H+抑制HA-的电离?
(5)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
本题解析:(1)对于平衡NH3+H2O NH3·H2O
NH3·H2O  NH+OH-来讲,向氨水中加入MgCl2固体时:Mg2++2OH-=Mg(OH)2↓,OH-浓度减小,平衡向右移移动;向浓氨水中加入少量NaOH固体时,OH-浓度增大,平衡向左移动,同时由于溶解过程中放出大量的热:NH3·H2O
NH+OH-来讲,向氨水中加入MgCl2固体时:Mg2++2OH-=Mg(OH)2↓,OH-浓度减小,平衡向右移移动;向浓氨水中加入少量NaOH固体时,OH-浓度增大,平衡向左移动,同时由于溶解过程中放出大量的热:NH3·H2O NH3↑+H2O,故有刺激性气体逸出
NH3↑+H2O,故有刺激性气体逸出
(2)氯化铁水解的离子方程式为Fe3+? + 3H2O Fe(OH)3? + 3H+,当向氯化铁溶液中加入碳酸钙粉末,CaCO3 + 2H+===?Ca2+ + H2O +CO2↑,H+浓度减小,平衡向正向移动,使水解产物Fe(OH)3大量生成,故有红褐色Fe(OH)3沉淀生成
Fe(OH)3? + 3H+,当向氯化铁溶液中加入碳酸钙粉末,CaCO3 + 2H+===?Ca2+ + H2O +CO2↑,H+浓度减小,平衡向正向移动,使水解产物Fe(OH)3大量生成,故有红褐色Fe(OH)3沉淀生成
(3)溶液中存在溶解平衡:Mg(OH)2 (S)  ?Mg2+(aq)+2OH-(aq) ,加入NH4Cl溶液会发生OH-+NH4+=NH3·H2O?,导致平衡向溶解方向移动,故悬浊液逐渐溶解
?Mg2+(aq)+2OH-(aq) ,加入NH4Cl溶液会发生OH-+NH4+=NH3·H2O?,导致平衡向溶解方向移动,故悬浊液逐渐溶解
(Ⅱ)(1)H2A全部电离为离子,故为强电解质
(2)由于HA-在溶液中存在平衡:HA- A2-+H+,故Na2A电离出的A2-可水解使溶液呈碱性:A2-+H2O
A2-+H+,故Na2A电离出的A2-可水解使溶液呈碱性:A2-+H2O HA-+OH-
HA-+OH-
(3)NaHA电离出的HA—是强酸H2A对应的离子,不水解,但可电离使溶液呈酸性:HA— H++ A2—,故NaHA溶液为酸性
H++ A2—,故NaHA溶液为酸性
(4)0.1mol·L-1NaHA 溶液中c(H+)=0.01mol·L-1;0.1mol·L-1 H2A溶液可全部电离:H2A=H++HA—,所产生的c(H+)、c(HA—)为0.1mol·L-1,由于H2A第1步电离产生的H+抑制HA-的电离,故c(HA—)离子出的c(H+)必定小于0.01mol·L-1,溶液中c(H+)必定小于0.11mol·L-1
(5)0.1mol·L NaHA溶液中主要存在的离子为c(Na+)、c(HA-),由于c(HA-)部分电离,c(Na+)>c(HA-),溶液呈酸性,同时由于H2O H++OH-,故c(H+)>c(A2-)>c(OH-),则 NaHA溶液中各离子浓度由大到小的顺序是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
H++OH-,故c(H+)>c(A2-)>c(OH-),则 NaHA溶液中各离子浓度由大到小的顺序是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
本题难度:简单
5、选择题 常温下,将等体积、等物质的量浓度的NaOH溶液和CH3COOH溶液混合,混合液呈
A.中性
B.碱性
C.酸性
D.无法确定
参考答案:B
本题解析:等体积等浓度的氢氧化钠溶液和醋酸溶液混合,恰好中和生成醋酸钠,醋酸钠水解溶液呈碱性。
点评:理解盐类水解的本质:盐电离出来的离子与水电离出来的H+或OH-结合生成弱电解质,破坏水的电离平衡。
本题难度:一般